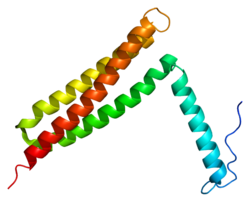FAK
FAK(focal adhesion kinase、フォーカルアドヒージョンキナーゼ、焦点接着キナーゼ、接着斑キナーゼ)またはPTK2(protein tyrosine kinase 2)は、ヒトではPTK2遺伝子によってコードされているタンパク質である[4]。FAKはフォーカルアドヒージョン関連プロテインキナーゼであり、細胞接着(細胞が互いにまたは周囲の環境とどのように結合するか)や拡散過程(細胞がどのように移動するか)に関与している[5]。FAKが遮断されると、がん細胞は移動性が低下し転移能が低下することが示されている[6]。
機能
編集PTK2遺伝子は非受容体型チロシンキナーゼをコードする。このタンパク質は、細胞外マトリックスの構成要素への接着を行うフォーカルアドヒージョンに濃縮されている。チロシンキナーゼのFAKサブファミリーに属し、このファミリーには他にPYK2が含まれるが、他のサブファミリーのキナーゼとの有意な配列類似性はみられない。また、大きなFERMドメインが存在する[7][8]。
特定種の血液細胞を除いて、大部分の細胞はFAKを発現している。FAKのチロシンキナーゼ活性は、細胞遊走の初期段階に重要な役割を果たす。FAKは発生過程で必要であり、FAKの喪失は致死となる。FAKが細胞遊走に絶対に必要とされるわけではないことは矛盾のようであるが、がん抑制因子p53の調節など、細胞内で他の役割にも関与している可能性がある[9]。
FAKは125 kDaのタンパク質で、フォーカルアドヒージョンのダイナミクス、細胞の運動性と生存に関与している。FAKは高度に保存された非受容体型チロシンキナーゼであり、もともとはがん遺伝子にコードされチロシンキナーゼv-srcの基質として同定された[10]。この細胞質型キナーゼは細胞遊走、分裂促進因子に対する応答、細胞の生存など細胞内で多様な役割を持っている。FAKは一般的にフォーカルアドヒージョンに局在している。フォーカルアドヒージョンは細胞外マトリックスと細胞質の細胞骨格を連結する多タンパク質構造である。フォーカルアドヒージョンの他の構成要素としては、アクチン、フィラミン、ビンキュリン、タリン、パキシリン、テンシン[11]、RSU1などがある。
調節
編集FAKはインテグリンのエンゲージメント、成長因子による刺激、分裂促進性神経ペプチドの作用に応答してリン酸化される[12][13]。インテグリンは細胞外マトリックスへのエンゲージメントに伴って密集するヘテロ二量体型膜貫通糖タンパク質であり、FAKのリン酸化とフォーカルアドヒージョンへのリクルートを引きこす[14][15]。FAKの活性はFRNK(FAK-related nonkinase)と呼ばれる内因性阻害因子の発現によって減弱する。FRNKは、FAKのC末端の非触媒ドメインのみからなる、切り詰められたタンパク質である[16]。
アポトーシスにおける役割
編集ヒトの内皮細胞でのアポトーシスシグナル伝達の初期過程において、FAKはカスパーゼ-3によってAsp772で切断され、約90 kDaと約35 kDaの2つの断片が形成される。小さい方の断片は"killer FAT"と呼ばれ、細胞死シグナル伝達と関係したドメインとなる[17]。アポトーシス過程では、FAKは細胞の円形化(rounding)、接着点の喪失、ブレブの形成(blebbing)などアポトーシス時の膜構造の形成に寄与する重要な因子である[18]。ブレブの形成は細胞皮質のアクチンリングの収縮を伴い、クロマチンの凝縮と核の断片化が続く[19]。FAKの過剰発現はアポトーシスの阻害と、転移性腫瘍の有病率の増加をもたらす[18]。
構造
編集FAKには4つの明確な領域またはドメインが存在する。これらのドメインのうち、N末端のFERMドメインとキナーゼドメイン(触媒ドメイン)は自己阻害性相互作用を行う。この相互作用は2つのドメインの間の疎水性相互作用によるものであると考えられているが[20]、キナーゼドメインの活性化を防ぎ、それによってFAKのシグナル伝達機能を防いでいる。この自己阻害性相互作用の解除は細胞質では起こらず、フォーカルアドヒージョンで起こることが示されている。そのため、相互作用の解除にはフォーカルアドヒージョンのタンパク質との相互作用が必要であると考えられており、おそらくフォーカルアドヒージョンを介して伝達される機械力の結果生じると考えられている。
C末端
編集C末端領域の159アミノ酸はFAT(focal adhesion targeting domain)と呼ばれており、FAKのフォーカルアドヒージョンへの標的化を担うことが示されている[21]。このドメインはバンドル状に配置された4本のαヘリックス(ヘリックスバンドル)から構成される。最もN末端側のヘリックスにはリン酸化が行われるチロシン残基(Y925)が存在し、シグナル伝達への関与が示唆されている。ヘリックス間の2つの疎水的パッチ(1番目と4番目、2番目と3番目のヘリックスによってそれぞれ形成される)はパキシリンの短いヘリカルドメインを結合することが示されている[22]。
N末端
編集N末端ドメインの機能ははっきりしないが、β1インテグリンサブユニットと相互作用することがin vitroで示されており、細胞外マトリックス-インテグリンクラスターからのシグナルの伝達に関与していると考えられている[23]。しかしながら、この相互作用の重要性に疑問も投げかける研究も存在し、β3インテグリンサブユニットの細胞質領域との相互作用が重要であることが示唆されている[24]。
FAKのN末端ドメインは、赤血球で最初に同定されたバンド4.1ドメインと高い配列類似性を示す。このバンド4.1ドメインはグリコフォリンCなどの膜貫通タンパク質の細胞質領域、アクチン、スペクトリンに結合する[25]。このことはFAKのN末端領域が細胞骨格の固定に関与している可能性を示唆しているが、その正確な役割はいまだ明らかではない。
触媒/調節ドメイン
編集N末端領域とC末端領域の間には触媒ドメインが位置する。このキナーゼドメインの活性化ループのリン酸化がFAKのキナーゼ活性には重要である[26]。
臨床的意義
編集FAKのmRNAのレベルは漿液性卵巣腫瘍の約37%、浸潤性乳がんの約26%で上昇しており、たのいくつかの悪性腫瘍でも上昇がみられる[27]。
薬剤標的として
編集FAK阻害剤
編集FAKは多くのがんに関与しているため、FAKを阻害する薬剤の探索と評価が行われている[28]。例えば2010年の時点では、PF-573228(PF-228)、PF-562271(PF-271)、NVP-226、Y15 (1,2,4,5-benzenetetraamine tetrahydrochloride)、PND-1186などが開発されている[28]。
2013年までに、GSK2256098とPF-573228は少なくとも第I相試験が完了している[28]。
2014年時点で臨床試験が行われている他のFAK阻害剤には、VS-6062(PF-562271)、VS-6063(PF-04554878 デファクチニブ)、VS-4718(PND-1186)がある[27]。これらは全てATP競合型キナーゼ阻害剤である。VS-6063はKRAS変異型非小細胞肺癌の患者に対する第II相試験(Trial ID: NCT01951690)が行われており、腫瘍と関係したINK4a/Arfとp53の変異に対して応答がどのように依存しているかの試験が行われている[27]。
相互作用
編集FAK(PTK2)は次に挙げる因子と相互作用することが示されている。
- BCAR1[30][31][32][33][34][35]
- BMX[36]
- CD61[37][38]
- CRK[31][39]
- DCC[40]
- FYN[41][42]
- GIT1[43][44][45]
- GRB2[32][39][41][46][47]
- GRB7[48]
- IRS1[49]
- ITGB5[37]
- JAK2[50][51]
- MAPK8IP3[52]
- NCK1[53][54]
- NCK2[54]
- NEDD9[55]
- NEO1[40]
- P53[56]
- PIK3R1[57]
- PTEN[58][59]
- PXN[35][60][61][62][63]
[64][65][66][67][68] - RB1CC1[69]
- STAT1[70]
- Src[31][39][41][49][71][72]
- SYK[38][73]
- TGFB1I1[61][74][75]
- TLN1[60][76]
- TSC2[77]
- YAP1[78]
出典
編集- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000022607 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Expression of an N-terminally truncated form of human focal adhesion kinase in brain”. Biochemical and Biophysical Research Communications 190 (1): 140–7. (January 1993). doi:10.1006/bbrc.1993.1022. PMID 8422239.
- ^ Blackshaw, S. E.; Dow, J. Kamal; Lackie, J. M. (1999). The dictionary of cell and molecular biology (3rd ed.). San Diego: Academic Press. ISBN 978-0-12-432565-4
- ^ “FAK alters invadopodia and focal adhesion composition and dynamics to regulate breast cancer invasion”. The Journal of Cell Biology 185 (2): 357–70. (2009). doi:10.1083/jcb.200809110. PMC 2700377. PMID 19364917.
- ^ “SCOPe 2.07: Protein: Focal adhesion kinase 1” (英語). scop.berkeley.edu. 2021年9月5日閲覧。
- ^ “PTK2 - Focal adhesion kinase 1 - Gallus gallus (Chicken) - PTK2 gene & protein” (英語). www.uniprot.org. 2021年9月5日閲覧。
- ^ “Entrez Gene: PTK2 PTK2 protein tyrosine kinase 2”. 28 October 2008閲覧。
- ^ “Regulation of focal adhesion-associated protein tyrosine kinase by both cellular adhesion and oncogenic transformation”. Nature 358 (6388): 690–2. (August 1992). Bibcode: 1992Natur.358..690G. doi:10.1038/358690a0. PMID 1379699.
- ^ “Rho-stimulated contractility drives the formation of stress fibers and focal adhesions”. The Journal of Cell Biology 133 (6): 1403–15. (June 1996). doi:10.1083/jcb.133.6.1403. PMC 2120895. PMID 8682874.
- ^ “Vascular endothelial growth factor stimulates tyrosine phosphorylation and recruitment to new focal adhesions of focal adhesion kinase and paxillin in endothelial cells”. The Journal of Biological Chemistry 272 (24): 15442–51. (June 1997). doi:10.1074/jbc.272.24.15442. PMID 9182576.
- ^ “Focal adhesion kinase (p125FAK): a point of convergence in the action of neuropeptides, integrins, and oncogenes”. Cell 71 (6): 891–4. (December 1992). doi:10.1016/0092-8674(92)90385-P. PMID 1458538.
- ^ “Focal adhesions: transmembrane junctions between the extracellular matrix and the cytoskeleton”. Annual Review of Cell Biology 4: 487–525. (1988). doi:10.1146/annurev.cb.04.110188.002415. PMID 3058164.
- ^ “Tyrosine phosphorylation of paxillin and pp125FAK accompanies cell adhesion to extracellular matrix: a role in cytoskeletal assembly”. The Journal of Cell Biology 119 (4): 893–903. (November 1992). doi:10.1083/jcb.119.4.893. PMC 2289706. PMID 1385444.
- ^ “Selective expression of an endogenous inhibitor of FAK regulates proliferation and migration of vascular smooth muscle cells”. Molecular and Cellular Biology 21 (5): 1565–72. (March 2001). doi:10.1128/MCB.21.5.1565-1572.2001. PMC 86702. PMID 11238893.
- ^ Schlaepfer, D. D.; Hauck, C. R.; Sieg, D. J. (1999). “Signaling through focal adhesion kinase”. Progress in Biophysics and Molecular Biology 71 (3-4): 435–478. doi:10.1016/s0079-6107(98)00052-2. ISSN 0079-6107. PMID 10354709.
- ^ a b “Metastasis: a question of life or death”. Nature Reviews. Cancer 6 (6): 449–58. (June 2006). doi:10.1038/nrc1886. PMID 16723991.
- ^ “Cytoskeleton and apoptosis”. Biochemical Pharmacology 76 (1): 11–8. (July 2008). doi:10.1016/j.bcp.2008.03.016. PMID 18462707.
- ^ “Structural basis for the autoinhibition of focal adhesion kinase”. Cell 129 (6): 1177–87. (June 2007). doi:10.1016/j.cell.2007.05.041. PMC 2077847. PMID 17574028.
- ^ “Identification of sequences required for the efficient localization of the focal adhesion kinase, pp125FAK, to cellular focal adhesions”. The Journal of Cell Biology 123 (4): 993–1005. (November 1993). doi:10.1083/jcb.123.4.993. PMC 2200138. PMID 8227154.
- ^ “Paxillin, a tyrosine phosphorylated focal adhesion-associated protein binds to the carboxyl terminal domain of focal adhesion kinase”. Molecular Biology of the Cell 6 (6): 637–47. (June 1995). doi:10.1091/mbc.6.6.637. PMC 301225. PMID 7579684.
- ^ “Focal adhesion kinase and paxillin bind to peptides mimicking beta integrin cytoplasmic domains”. The Journal of Cell Biology 130 (5): 1181–7. (September 1995). doi:10.1083/jcb.130.5.1181. PMC 2120552. PMID 7657702.
- ^ “The role of conserved amino acid motifs within the integrin beta3 cytoplasmic domain in triggering focal adhesion kinase phosphorylation”. The Journal of Biological Chemistry 272 (12): 7892–8. (March 1997). doi:10.1074/jbc.272.12.7892. PMID 9065456.
- ^ “Janus kinases and focal adhesion kinases play in the 4.1 band: a superfamily of band 4.1 domains important for cell structure and signal transduction”. Molecular Medicine 4 (12): 751–69. (December 1998). doi:10.1007/BF03401769. PMC 2230389. PMID 9990861.
- ^ “Tyrosine phosphorylation of focal adhesion kinase at sites in the catalytic domain regulates kinase activity: a role for Src family kinases”. Molecular and Cellular Biology 15 (2): 954–63. (February 1995). doi:10.1128/MCB.15.2.954. PMC 231984. PMID 7529876.
- ^ a b c “FAK in cancer: mechanistic findings and clinical applications”. Nature Reviews. Cancer 14 (9): 598–610. (September 2014). doi:10.1038/nrc3792. PMC 4365862. PMID 25098269.
- ^ a b c “Evolving therapies and FAK inhibitors for the treatment of cancer”. Anti-Cancer Agents in Medicinal Chemistry 10 (10): 722–34. (December 2010). doi:10.2174/187152010794728657. PMC 3274818. PMID 21291406.
- ^ “Researchers Stop Once-Promising Mesothelioma Clinical Trial” (英語). Mesothelioma Center - Vital Services for Cancer Patients & Families. 2021年9月10日閲覧。
- ^ “p130CAS forms a signaling complex with the adapter protein CRKL in hematopoietic cells transformed by the BCR/ABL oncogene”. The Journal of Biological Chemistry 271 (41): 25198–203. (October 1996). doi:10.1074/jbc.271.41.25198. PMID 8810278.
- ^ a b c “Differential regulation of cell motility and invasion by FAK”. The Journal of Cell Biology 160 (5): 753–67. (March 2003). doi:10.1083/jcb.200212114. PMC 2173366. PMID 12615911.
- ^ a b “An SH3 domain-containing GTPase-activating protein for Rho and Cdc42 associates with focal adhesion kinase”. Molecular and Cellular Biology 16 (6): 3169–78. (June 1996). doi:10.1128/MCB.16.6.3169. PMC 231310. PMID 8649427.
- ^ “Phosphatidylinositol 3,4,5-trisphosphate directs association of Src homology 2-containing signaling proteins with gelsolin”. The Journal of Biological Chemistry 276 (50): 47434–44. (December 2001). doi:10.1074/jbc.M107494200. PMID 11577104.
- ^ “Activation of Wiskott-Aldrich syndrome protein and its association with other proteins by stromal cell-derived factor-1alpha is associated with cell migration in a T-lymphocyte line”. Experimental Hematology 30 (7): 761–6. (July 2002). doi:10.1016/s0301-472x(02)00823-8. PMID 12135674.
- ^ a b “Stromal cell-derived factor-1alpha stimulates tyrosine phosphorylation of multiple focal adhesion proteins and induces migration of hematopoietic progenitor cells: roles of phosphoinositide-3 kinase and protein kinase C”. Blood 95 (8): 2505–13. (April 2000). doi:10.1182/blood.V95.8.2505. PMID 10753828.
- ^ “Regulation of the PH-domain-containing tyrosine kinase Etk by focal adhesion kinase through the FERM domain”. Nature Cell Biology 3 (5): 439–44. (May 2001). doi:10.1038/35074500. PMID 11331870.
- ^ a b “Src-mediated coupling of focal adhesion kinase to integrin alpha(v)beta5 in vascular endothelial growth factor signaling”. The Journal of Cell Biology 157 (1): 149–60. (April 2002). doi:10.1083/jcb.200109079. PMC 2173263. PMID 11927607.
- ^ a b “Thrombspondin acts via integrin-associated protein to activate the platelet integrin alphaIIbbeta3”. The Journal of Biological Chemistry 272 (23): 14740–6. (June 1997). doi:10.1074/jbc.272.23.14740. PMID 9169439.
- ^ a b c “Protein tyrosine phosphatase-PEST regulates focal adhesion disassembly, migration, and cytokinesis in fibroblasts”. The Journal of Cell Biology 144 (5): 1019–31. (March 1999). doi:10.1083/jcb.144.5.1019. PMC 2148201. PMID 10085298.
- ^ a b “Focal adhesion kinase in netrin-1 signaling”. Nature Neuroscience 7 (11): 1204–12. (November 2004). doi:10.1038/nn1330. PMID 15494733.
- ^ a b c “Specific interactions of neuronal focal adhesion kinase isoforms with Src kinases and amphiphysin”. Journal of Neurochemistry 84 (2): 253–65. (January 2003). doi:10.1046/j.1471-4159.2003.01519.x. PMID 12558988.
- ^ “The role of the Src homology 3-Src homology 2 interface in the regulation of Src kinases”. The Journal of Biological Chemistry 276 (20): 17199–205. (May 2001). doi:10.1074/jbc.M011185200. PMID 11278857.
- ^ “Interaction between liprin-alpha and GIT1 is required for AMPA receptor targeting”. The Journal of Neuroscience 23 (5): 1667–77. (March 2003). doi:10.1523/JNEUROSCI.23-05-01667.2003. PMC 6741975. PMID 12629171.
- ^ “The GIT family of proteins forms multimers and associates with the presynaptic cytomatrix protein Piccolo”. The Journal of Biological Chemistry 278 (8): 6291–300. (February 2003). doi:10.1074/jbc.M212287200. PMID 12473661.
- ^ “Coupling of PAK-interacting exchange factor PIX to GIT1 promotes focal complex disassembly”. Molecular and Cellular Biology 20 (17): 6354–63. (September 2000). doi:10.1128/MCB.20.17.6354-6363.2000. PMC 86110. PMID 10938112.
- ^ “FAK integrates growth-factor and integrin signals to promote cell migration”. Nature Cell Biology 2 (5): 249–56. (May 2000). doi:10.1038/35010517. PMID 10806474.
- ^ “The structural basis of localization and signaling by the focal adhesion targeting domain”. Structure 10 (3): 319–27. (March 2002). doi:10.1016/s0969-2126(02)00717-7. PMID 12005431.
- ^ “Association of focal adhesion kinase with Grb7 and its role in cell migration”. The Journal of Biological Chemistry 274 (34): 24425–30. (August 1999). doi:10.1074/jbc.274.34.24425. PMID 10446223.
- ^ a b “Insulin receptor substrate-1 as a signaling molecule for focal adhesion kinase pp125(FAK) and pp60(src)”. The Journal of Biological Chemistry 273 (48): 32244–53. (November 1998). doi:10.1074/jbc.273.48.32244. PMID 9822703.
- ^ “Growth hormone stimulates the tyrosine phosphorylation and association of p125 focal adhesion kinase (FAK) with JAK2. Fak is not required for stat-mediated transcription”. The Journal of Biological Chemistry 273 (17): 10682–9. (April 1998). doi:10.1074/jbc.273.17.10682. PMID 9553131.
- ^ “Regulation of neutrophil adhesion by pituitary growth hormone accompanies tyrosine phosphorylation of Jak2, p125FAK, and paxillin”. Journal of Immunology 165 (4): 2116–23. (August 2000). doi:10.4049/jimmunol.165.4.2116. PMID 10925297.
- ^ “A scaffold protein in the c-Jun N-terminal kinase signaling pathway is associated with focal adhesion kinase and tyrosine-phosphorylated”. Oncogene 21 (42): 6488–97. (September 2002). doi:10.1038/sj.onc.1205840. PMID 12226752.
- ^ “Structure and function of Cas-L, a 105-kD Crk-associated substrate-related protein that is involved in beta 1 integrin-mediated signaling in lymphocytes”. The Journal of Experimental Medicine 184 (4): 1365–75. (October 1996). doi:10.1084/jem.184.4.1365. PMC 2192828. PMID 8879209.
- ^ a b “Nck-2 interacts with focal adhesion kinase and modulates cell motility”. The International Journal of Biochemistry & Cell Biology 34 (7): 791–805. (July 2002). doi:10.1016/s1357-2725(02)00002-x. PMID 11950595.
- ^ “Human enhancer of filamentation 1, a novel p130cas-like docking protein, associates with focal adhesion kinase and induces pseudohyphal growth in Saccharomyces cerevisiae”. Molecular and Cellular Biology 16 (7): 3327–37. (July 1996). doi:10.1128/mcb.16.7.3327. PMC 231327. PMID 8668148.
- ^ “Nuclear FAK promotes cell proliferation and survival through FERM-enhanced p53 degradation”. Molecular Cell 29 (1): 9–22. (January 2008). doi:10.1016/j.molcel.2007.11.031. PMC 2234035. PMID 18206965.
- ^ “Integrin-dependent translocation of phosphoinositide 3-kinase to the cytoskeleton of thrombin-activated platelets involves specific interactions of p85 alpha with actin filaments and focal adhesion kinase”. The Journal of Cell Biology 129 (3): 831–42. (May 1995). doi:10.1083/jcb.129.3.831. PMC 2120444. PMID 7537275.
- ^ “PTEN interactions with focal adhesion kinase and suppression of the extracellular matrix-dependent phosphatidylinositol 3-kinase/Akt cell survival pathway”. The Journal of Biological Chemistry 274 (29): 20693–703. (July 1999). doi:10.1074/jbc.274.29.20693. PMID 10400703.
- ^ “PTEN regulates tumor cell adhesion of colon carcinoma cells under dynamic conditions of fluid flow”. Oncogene 21 (9): 1450–60. (February 2002). doi:10.1038/sj.onc.1205213. PMID 11857088.
- ^ a b “Differential regulation of Pyk2 and focal adhesion kinase (FAK). The C-terminal domain of FAK confers response to cell adhesion”. The Journal of Biological Chemistry 273 (4): 2384–9. (January 1998). doi:10.1074/jbc.273.4.2384. PMID 9442086.
- ^ a b “Cell adhesion kinase beta forms a complex with a new member, Hic-5, of proteins localized at focal adhesions”. The Journal of Biological Chemistry 273 (2): 1003–14. (January 1998). doi:10.1074/jbc.273.2.1003. PMID 9422762.
- ^ “Focal adhesion kinase and p130Cas mediate both sarcomeric organization and activation of genes associated with cardiac myocyte hypertrophy”. Molecular Biology of the Cell 12 (8): 2290–307. (August 2001). doi:10.1091/mbc.12.8.2290. PMC 58595. PMID 11514617.
- ^ “Paxillin LD4 motif binds PAK and PIX through a novel 95-kD ankyrin repeat, ARF-GAP protein: A role in cytoskeletal remodeling”. The Journal of Cell Biology 145 (4): 851–63. (May 1999). doi:10.1083/jcb.145.4.851. PMC 2133183. PMID 10330411.
- ^ “A fragment of paxillin binds the alpha 4 integrin cytoplasmic domain (tail) and selectively inhibits alpha 4-mediated cell migration”. The Journal of Biological Chemistry 277 (23): 20887–94. (June 2002). doi:10.1074/jbc.M110928200. PMID 11919182.
- ^ “Monocyte cells and cancer cells express novel paxillin isoforms with different binding properties to focal adhesion proteins”. The Journal of Biological Chemistry 272 (11): 7437–44. (March 1997). doi:10.1074/jbc.272.11.7437. PMID 9054445.
- ^ “Identification of LIM3 as the principal determinant of paxillin focal adhesion localization and characterization of a novel motif on paxillin directing vinculin and focal adhesion kinase binding”. The Journal of Cell Biology 135 (4): 1109–23. (November 1996). doi:10.1083/jcb.135.4.1109. PMC 2133378. PMID 8922390.
- ^ “Interaction of Hic-5, A senescence-related protein, with focal adhesion kinase”. The Journal of Biological Chemistry 273 (41): 26516–21. (October 1998). doi:10.1074/jbc.273.41.26516. PMID 9756887.
- ^ “Cytoskeleton-dependent tyrosine phosphorylation of the p130(Cas) family member HEF1 downstream of the G protein-coupled calcitonin receptor. Calcitonin induces the association of HEF1, paxillin, and focal adhesion kinase”. The Journal of Biological Chemistry 274 (35): 25093–8. (August 1999). doi:10.1074/jbc.274.35.25093. PMID 10455189.
- ^ “Suppression of Pyk2 kinase and cellular activities by FIP200”. The Journal of Cell Biology 149 (2): 423–30. (April 2000). doi:10.1083/jcb.149.2.423. PMC 2175150. PMID 10769033.
- ^ “Focal adhesion kinase activates Stat1 in integrin-mediated cell migration and adhesion”. The Journal of Biological Chemistry 276 (22): 19512–23. (June 2001). doi:10.1074/jbc.M009063200. PMID 11278462.
- ^ “Focal adhesion kinase enhances signaling through the Shc/extracellular signal-regulated kinase pathway in anaplastic astrocytoma tumor biopsy samples”. Cancer Research 62 (9): 2699–707. (May 2002). PMID 11980671.
- ^ “Site-specific phosphorylation of platelet focal adhesion kinase by low-density lipoprotein”. The Biochemical Journal 369 (Pt 2): 407–16. (January 2003). doi:10.1042/BJ20020410. PMC 1223094. PMID 12387730.
- ^ “Relocation of Syk protein-tyrosine kinase to the actin filament network and subsequent association with Fak”. European Journal of Biochemistry 248 (3): 827–33. (September 1997). doi:10.1111/j.1432-1033.1997.00827.x. PMID 9342235.
- ^ “Hic-5-reduced cell spreading on fibronectin: competitive effects between paxillin and Hic-5 through interaction with focal adhesion kinase”. Molecular and Cellular Biology 21 (16): 5332–45. (August 2001). doi:10.1128/MCB.21.16.5332-5345.2001. PMC 87257. PMID 11463817.
- ^ “Characterization of a focal adhesion protein, Hic-5, that shares extensive homology with paxillin”. Journal of Cell Science 112 (2): 181–90. (January 1999). PMID 9858471.
- ^ “Interaction of focal adhesion kinase with cytoskeletal protein talin”. The Journal of Biological Chemistry 270 (28): 16995–9. (July 1995). doi:10.1074/jbc.270.28.16995. PMID 7622520.
- ^ “Association of focal adhesion kinase with tuberous sclerosis complex 2 in the regulation of s6 kinase activation and cell growth”. The Journal of Biological Chemistry 281 (49): 37321–9. (December 2006). doi:10.1074/jbc.M605241200. PMID 17043358.
- ^ “FAK controls the mechanical activation of YAP, a transcriptional regulator required for durotaxis” (英語). FASEB Journal 32 (2): 1099–1107. (October 2017). doi:10.1096/fj.201700721r. PMID 29070586.
関連文献
編集- “Beta 1-integrin-mediated cell signaling in T lymphocytes”. Journal of Dermatological Science 23 (2): 75–86. (June 2000). doi:10.1016/S0923-1811(99)00096-1. PMID 10808124.
- “Biochemical signals and biological responses elicited by the focal adhesion kinase”. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research 1540 (1): 1–21. (July 2001). doi:10.1016/S0167-4889(01)00123-9. PMID 11476890.
- “Tyrosine phosphorylation of paxillin, FAK, and p130CAS: effects on cell spreading and migration”. Frontiers in Bioscience 7 (1–3): d143–50. (January 2002). doi:10.2741/panetti. PMID 11779709.
- “The focal adhesion kinase--a regulator of cell migration and invasion”. IUBMB Life 53 (2): 115–9. (February 2002). doi:10.1080/15216540211470. PMID 12049193.
- “Focal adhesion kinase signaling activities and their implications in the control of cell survival and motility”. Frontiers in Bioscience 8 (4): d982–96. (May 2003). doi:10.2741/1114. PMID 12700132.
- “FAK regulates biological processes important for the pathogenesis of cancer”. Cancer Metastasis Reviews 22 (4): 359–74. (December 2003). doi:10.1023/A:1023725029589. PMID 12884911.
関連項目
編集外部リンク
編集- MBInfo: FAK
- FAK Info with links in the Cell Migration Gateway Archived 2014-12-11 at the Wayback Machine.
- PTK2 protein, human - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
- "Breaking down cancer’s wall of resistance", by DR Nick Peel, Cancer Research UK, Science blog, August 2014
- Overview of all the structural information available in the PDB for UniProt: Q05397 (Human Focal adhesion kinase 1) at the PDBe-KB.
- Overview of all the structural information available in the PDB for UniProt: P34152 (Mouse Focal adhesion kinase 1) at the PDBe-KB.