インテグリン
この記事には独自研究が含まれているおそれがあります。 |
インテグリン(英: integrin)は、細胞表面の原形質膜にあるタンパク質で、細胞接着分子である。細胞外マトリックスのレセプターとして細胞 - 細胞外マトリックスの細胞接着(細胞基質接着)の主役である。また細胞 - 細胞の接着にも関与する。タンパク質分子としては、α鎖とβ鎖の2つのサブユニットからなるヘテロダイマーであり、異なるα鎖、β鎖が多数存在し、多様な組み合わせが可能である。
歴史的には、1985年、細胞接着分子・フィブロネクチンのレセプターとして最初に発見された。その後、多数のタンパク質がインテグリンと同定され、インテグリン・スーパーファミリーを形成している。細胞内では、アダプタータンパク質を介して細胞骨格のミクロフィラメントに結合し、細胞内シグナル伝達をする。
インテグリンは「α1β1」などと、αβの後に数字や記号を下付に書く方式と、「α1β1」と下付にしないで書く方式が混在して使われている。ここでも、両方式を混在して使う。
発見
編集フィブロネクチンレセプターとして
編集1973年、英国 王立がん研究基金 のリチャード・ハインズ(Richard O. Hynes)が細胞表面のフィブロネクチンを発見し[1]。1976年、米国・NIH・国立がん研究所のケネス・ヤマダ(K.M. Yamada)がフィブロネクチンの細胞接着活性を発見した[2]。細胞接着分子はその後たくさん発見されるが、フィブロネクチンはその最初だった。
細胞接着活性は、次のように観察された。フィブロネクチン溶液を培養皿や96穴プレートに入れ、1時間ほど室温放置すると、微量のフィブロネクチンが容器底面に吸着する。容器底面を洗い、生きた培養細胞をまくと、60 - 90分で、細胞は容器底面に接着し、丸い球形の細胞が伸展し、三角形-五角形の形状になる。フィブロネクチンをまかない容器(対照実験)では細胞は丸い形状のままである。
顕微鏡下で、全細胞中の伸展した細胞数を数え、細胞接着活性を数値化する。つまり、べちゃと伸展した細胞形状で細胞接着を観察していたことから、細胞はプレート上のフィブロネクチン分子全体に非特異的に結合することで細胞接着(実際は、細胞伸展)が起こると、当初、思われた。また、フィブロネクチンが巨大なタンパク質だったので、細胞はフィブロネクチン分子全体に非特異的に結合すると思わせる面もあった。
1980年頃、フィブロネクチンのヘパリン結合部位やコラーゲン結合部位が、フィブロネクチン分子のプロテアーゼ断片に担われていることがわかってきた。このことから、特定の結合部位は、フィブロネクチン分子の特定の部位(=ドメイン)に存在する「フィブロネクチンのドメイン構造説」が有力になり、フィブロネクチン分子の構造と機能がドメイン構造説で理解されるようになった。米国の西海岸のワシントン大学・箱守仙一郎研究室の関口清俊と、東海岸の国立がん研究所・ケネス・ヤマダ研究室で林正男が、ドメイン構造解明に大きく貢献した[3][4]。
ドメイン構造説が有力になるにつれ、細胞接着活性も特定のドメインに存在するのではないかと思われ、その考えで研究を進めた米国のエルキ・ルースラーティ(E. Ruoslahti [5] )は、1984年、「フィブロネクチンの細胞接着部位はたった4つのアミノ酸Arg-Gly-Asp-Ser(RGDS)(RGD配列)に担われている」という驚くべき結果を発表した[6]。
RGD配列の発見は、とりもなおさず、細胞の方にも、細胞表面に特定のフィブロネクチン・レセプタータンパク質があるだろうと思わせた。
1985年、米国のエルキ・ルースラーティは、界面活性剤・オクチルグルコシドで可溶化した細胞膜タンパク質をフィブロネクチン・アフィニティークロマトグラフィーにかけた。非結合画分を洗い流した後、フィブロネクチンに結合する細胞膜タンパク質を、RGD配列を含むRGDペプチドで溶出した。すると、還元剤なし条件のSDS電気泳動で、分子量は140 kDaの1本のバンドが検出できた。フィブロネクチン・レセプタータンパク質を世界で最初に単離したのである。ポイントは、RGD配列を含むRGDペプチドで特異的に溶出させる手法を用いたことだった[7]。
一方、全く別の方向からも、フィブロネクチン・レセプタータンパク質が見つかった。1970年代、ドイツのジョルジュ・J・F・ケーラーとアルゼンチン生まれのセーサル・ミルスタインがモノクローナル抗体の作製法を開発し、1984年、この開発でノーベル生理学・医学賞を受賞したが、1980年代初期には、世界の先端的研究室にモノクローナル抗体作製技術が普及し始めていた。
米国のホルビッツ(Horwitz AF)は、この技術を応用し、培養細胞の膜タンパク質に対するモノクローナル抗体を作り、フィブロネクチン上での細胞接着を阻害するモノクローナル抗体(想定抗原はフィブロネクチン・レセプタータンパク質)として、特定のハイブリドーマを選別した。その結果、JG22やCSATと命名されたモノクローナル抗体を得ていた。
1985年、米国・NIH・国立がん研究所のケネス・ヤマダ研究室の長谷川孝幸・悦子夫妻は、フィブロネクチン・レセプタータンパク質を単離する目的で、JG22の改良型JG22Eを不溶性の担体に固定し、抗体(JG22E)・アフィニティークロマトグラフィーを試みた。この抗体を固定したカラムに、ニワトリ13日目胚組織から調製した細胞膜成分を、界面活性剤・オクチルグルコシドで可溶化し、カラムに通し、JG22Eに特異的に結合するフィブロネクチン・レセプタータンパク質を単離した。還元剤なしのSDS電気泳動で140 kDaの1本のバンド、還元剤入りだと、155 kDa、135 kDa、120 kDaの3本のバンドになった[8]。同年、米国のホルビッツ(Horwitz AF)も同じようなフィブロネクチン・レセプタータンパク質を発見した[9]。
翌1986年、リチャード・ハインズは、ホルビッツの単離したフィブロネクチン・レセプター]タンパク質のcDNAクローニングに成功し、塩基配列を決定した[10]。塩基配列に基づくアミノ酸配列から、フィブロネクチン・レセプタータンパク質は、細胞外でフィブロネクチンと結合し、細胞内でアクチンマイクロフィラメントと結合する細胞膜貫通タンパク質であるとされた。ハインズは、細胞外と細胞内を「統合する」(英語で「integrate」)機能に因み、フィブロネクチン・レセプタータンパク質を「インテグリン(integrin)」と命名した。
インテグリン・スーパーファミリー
編集その後、別の領域で研究されていたタンパク質のcDNA塩基配列が決定され、インテグリンと類似していることから、インテグリン・ファミリーが形成されていった。
細胞接着分子のレセプターのインテグリンを含めると、脊椎動物のインテグリンは4つの異なる研究領域で発見された。さらに、無脊椎動物にもインテグリンが発見され、合わせて、5つの領域で、インテグリン・スーパーファミリーが形成されていった。このように広範な領域でインテグリンが発見されたということは、インテグリンの生物学的機能・医学的重要性が、それだけ広範だということである。
1種類目のインテグリンファミリーは、最初に述べた細胞接着分子のレセプター群である。最初に発見されたフィブロネクチン・レセプタータンパク質と同じ1985年、同じエルキ・ルースラーティ研究室が、分子量125 kDaと115 kDaのビトロネクチン・レセプタータンパク質を単離した。翌1986年、ルースラーティ研究室の鈴木信太郎が、ビトロネクチン・レセプタータンパク質のcDNA塩基配列を解明すると、驚いたことに、フィブロネクチン・レセプタータンパク質の塩基配列とよく似ていた[14]。つまり、インテグリンはファミリーを形成していたのである。これが、細胞接着分子のレセプターとしての2つ目のインテグリンである。その後、細胞接着分子のレセプター群に同じようなインテグリンが発見されていく。
2種類目のインテグリンファミリーは、白血球の細胞表面の抗原で、免疫系細胞の分化マーカーとして同定されたタンパク質である。白血球の細胞表面の抗原は、CD分類(cluster of differentiation、分化クラスター)で命名されるが、cDNA塩基配列が決定されると、いくつかがインテグリン・ファミリーに属していることが判明した。1例をあげると、CD11aはインテグリンαLと同一である[15][16]。
3種類目のインテグリンファミリーは、VLA(very late antigen)シリーズである。VLAは、Tリンパ球を活性化した後、かなり遅れて発現する一群の表面抗原である。米国・ダナファーバーがん研究所のヘムラー(M.Hemler)研究室の高田義一は、1987年、VLAのcDNA塩基配列を決定すると、驚いたことに、インテグリンβ1グループのいくつかと同じだった[17]。1例をあげると、VLA‐1はインテグリンα1b1だったのだ。
4種類目のインテグリンファミリーは、血小板の膜にある糖タンパク質群である。血小板の膜の糖タンパク質群は、血小板の機能にとって重要だと考えられたが、機能がわからないまま、SDS電気泳動で主要な膜糖タンパク質が同定され、泳動バンドの位置から順番に「GPナニナニ」と番号がつけられ、機械的に命名されていた。GPは糖タンパク質(glycoprotein)という意味である。RGDペプチド・アフィニティークロマトグラフィーで、血小板膜の糖タンパク質・GPⅡb/Ⅲaが特異的に結合したことから、GPⅡb/Ⅲaはインテグリンファミリーだと、エルキ・ルースラーティ研究室が断定した[18]。1例をあげると、GPⅡb/ⅢaはインテグリンαⅡbβ3である。この発見で、血小板の血液凝固作用はインテグリンの細胞接着機能として捉えられるようになった。
5種類目のインテグリンファミリーは、無脊椎動物のインテグリンである。数例をあげる。ショウジョウバエは5種類のαサブユニットと2種類のβ サブユニットが発見され、 線虫は2種類のαサブユニットと1種類のβ サブユニットが発見された[19]。ウニからインテグリンβ サブユニットに類似のタンパク質が発見された[20]。アメーバにもインテグリンβ サブユニットに類似のタンパク質が発見され、「SibA」と命名された[21]。
構造
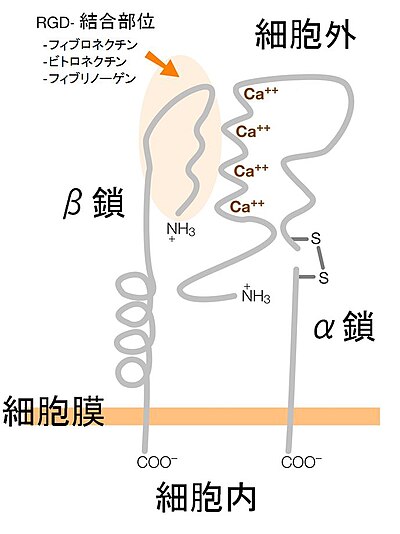
編集インテグリンはタンパク質で、分子としては、α鎖とβ鎖が1:1で会合しているヘテロダイマーである。
インテグリンα鎖は、1,000 - 1,200個のアミノ酸からなる分子量120 - 180 kDaの糖タンパク質で、少なくとも18種類が報告されている。
いくつかのα鎖には、細胞外領域のN末端側(図2では左側)に、約200個のアミノ酸からなるIドメイン(あい どめいん)がある(「I」はinserted、「挿入された」の意)。
- Iドメインがある・・・α1, α2, α10, α11, αD, αE, αL, αM, αX
- Iドメインがある・・・α3, α4, α5, α6, α7, α8, α9, αV, αⅡb
分子中央からN末端側(図2では左側)にDXDXDGXXD(Xは任意のアミノ酸)を基本構造とする配列が3 - 4個あり、これが2価カチオン結合部位である(図2ではCa++を示してある)。
細胞膜近くの細胞外領域で、いくつかのα鎖(α3、α5、α6、αⅡb、αv)は、ペプチド結合が1箇所、切断されているが、S‐S結合でつながっている。このため、還元剤ありなしでSDS電気泳動での移動位置が異なる。
さらにC末端の方にいくと(図2の右側)、細胞膜を貫通する領域があり、さらに、細胞内に約50個のアミノ酸からなる部分がある。
インテグリンβ鎖は、通常約750個のアミノ酸からなる分子量90 - 110 kDaの糖タンパク質で、少なくとも8種類が報告されている。このうちβ4だけが例外的な分子で、細胞質にさらに約1,000個のアミノ酸からなる部分がある。
図1に示すように、細胞外のN末端側にRGD配列に結合する部位がある。この結合には、α鎖の協力も必要である。
細胞外に4つのEGF様繰り返し構造があり。ここはシステインに富む(図1のクルクル丸くした部分)。このシステイン高含有領域があるため、還元剤なしでSDS電気泳動すると、β鎖の泳動位置は約140 kDa付近になる。
β鎖も細胞内に約80個のアミノ酸からなる部分があるが、特筆すべきことは、1個または2個のNPXY(Asn-Pro-Xaa-Tyr)モチーフ(Xは任意のアミノ酸)、つまり、リン酸化されるチロシン残基(Y)があることだ。このチロシンのリン酸化で、細胞膜裏打ちのタンパク質の結合など、インテグリンの細胞内シグナル伝達機能にとても重要な役割を果たす。
なお、機能との関係はつかめていないがα3、α6、β3、β4には選択的スプライシングが起こる。
分布
編集アメーバ、海綿、線虫、ウニからヒトまで、いろいろな動物種に幅広く存在する。細胞-基質間接着の結合装置である焦点接着(focal adhesion)と細胞-細胞間接着の結合装置である接着結合(アドヘレンス・ジャンクション、adherens junction)の両方に存在する。
脊椎動物インテグリンの種類
編集ヒトでは、少なくともαサブユニットが18種類、βサブユニットが8種類ある。ヘテロダイマーとしては、そのαβのすべての組み合わせが存在するのではない。ヒトでは、24種類の組み合わせしか見つかっていない(図3)。
インテグリンの主なリガンドは、細胞接着性タンパク質(cell-adhesive protein)や細胞外マトリックス分子である。例えば、フィブロネクチン、ビトロネクチン、ラミニン、コラーゲン、フィブリノーゲンなどである。
一般的に、1種類のレセプターは1種類のリガンドと結合する。ところが、インテグリンは、1種類のリガンドが多種類のインテグリンに結合する。また、逆に、多種類のリガンドが1種類のインテグリンにも結合する。「1対1」ではなく、「多対多」である。また、1つの細胞が多種類のインテグリンを発現する。
インテグリンを結合リガンドから分類すると以下のようである。
- ラミニン結合インテグリン・・・α1β1、α2β1、α3β1、α6β1、α7β1、α6β4
- コラーゲン結合インテグリン・・・α1β1、α2β1、α3β1、α10β1、α11β1
- 白血球インテグリン・・・αLβ2、αMβ2、αXβ2、αDβ2
- RGD配列認識インテグリン・・・α5β1、αVβ1、αVβ3、αVβ5、αVβ6、αVβ8、 αⅡbβ3
- LDV配列認識インテグリン・・・α4β1、α4β7、α9β1、αDβ2、αLβ2、αMβ2、αXβ2、αEβ7
ヒト・インテグリンαβ一覧表
編集ヒト・インテグリンの全24種を以下の表に示す[22][23]。
CD(シーディー、cluster of differentiation、分化クラスター)、VLA(ブイエルエイ、very late antigen)、GP(ジーピー、glycoprotein)という名称のあとに番号がついた別名は、「インテグリン・スーパーファミリー」に記載したように、それぞれの研究領域で発見・命名された分子がインテグリンだったという歴史を物語っている。各領域ではインテグリンという名称に統一されておらず、各領域での名称が用いられていることもある。
繰返しになるが、インテグリンは「α1β1」などと、αβの後の数字や記号を下付に書く方式と、「α1β1」と下付にしないで書く方式が混在して使われている。表では、下付方式を用いた。
| 名前 | 別名 | 分布 | 結合リガンド | 生理機能 | 関連疾患 |
|---|---|---|---|---|---|
| α1β1 | VLA-1 | 広範 | コラーゲン、ラミニン | 神経突起伸長、リンパ球浸潤 | 同種移植病 |
| α2β1 | VLA-2 | 広範 | コラーゲン、ラミニン、TSP、E-カドヘリン、テネイシン | 血小板凝集、癌の浸潤・転移 | 心臓脈管の疾患(?) |
| α3β1 | VLA-3 | 広範 | ラミニン‐5、TSP、uPAR | 腎臓、肺の形態形成、癌の浸潤・転移 | 糸球体炎 |
| α4β1 | VLA-4 | 白血球 | フィブロネクチン、VCAM-1、MAdCAM-1, TSP、OPN、ADAM、ICAM-4 | リンパ球、単球、好酸球の炎症部位への遊走 | 気管支炎、多発性硬化症 |
| α5β1 | VLA-5、フィブロネクチン受容体 | 広範 | フィブロネクチン、TSP、OPN、ADAM、COMP、L1 | 細胞の移動、細胞増殖、フィブロネクチンマトリックスの形成 | 炎症性腸疾患 |
| α6β1 | VLA-6、ラミニン受容体 | 広範 | ラミニン、TSP、ADAM、Cyr61 | 上皮細胞の極性、神経突起伸長、癌の浸潤・転移 | 炎症性腸疾患、ヒルシュスブルング病 |
| α7β1 | 筋肉、グリオーマ | ラミニン | 骨格筋の形成や恒常性の維持 | 筋ジストロフィ | |
| α8β1 | フィブロネクチン、ビトロネクチン、テネイシン、OPN、ネフロネクチン、LAP-TGFβ | 腎臓の形態形成、神経細胞のシナプス形成 | 不明 | ||
| α9β1 | テネイシン-C、OPN、VCAM-1、uPAR、プラスミン、アンジオスタチン、ADAM、VEGF-C、VEGF-D | 気管上皮に発現 | 不明 | ||
| α10β1 | 軟骨細胞 | コラーゲン、ラミニン | |||
| α11β1 | 骨格筋細胞、間質線維芽細胞 | コラーゲン | 細胞増殖 | 非小細胞肺癌 | |
| αvβ1 | 目のメラノーマ、神経腫瘍 | フィブロネクチン、Fbg、LAP-TGFβ、OPN、L1 | 細胞の移動、癌細胞の基質への接着 | 不明 | |
| αDβ2 | ICAM-1、VCAM-1、フィブロネクチン、Fbg、ビトロネクチン、Cyr61、プラスミノーゲン | 動脈壁の泡沫細胞の機能との関連 | 動脈硬化 | ||
| αLβ2 | CD11a/CD18、LFA-1 | Tリンパ球 | ICAM-1、ICAM-4 | 白血球の接着・走化性に関与、免疫寛容の誘導 | 白血球接着不全症 |
| αMβ2 | CD11b/CD18、Mac-1、CR3 | 好中球、単球 | Fbg, ICAM-1、ICAM-4、iC3b、因子X、ヘパリン | 好中球/単球と血管内皮との接着 | 白血球接着不全症、敗血症、動脈硬化、バセドウ病 |
| αXβ2 | CD11c/CD18, p150,95 | Fbg, ICAM-1、ICAM-4、iC3b、コラーゲン、ヘパリン | 単球/顆粒球と血管内皮との接着 | 白血球接着不全症 | |
| αⅡbβ3 | GPⅡb/Ⅲa、Fbgレセプター | 血小板 | Fbg、フィブロネクチン、ビトロネクチン、vWF、TSP、Cyr61、ICAM-4、L1 | 血小板の粘着・凝集、止血血栓形成 | 血小板無力症 |
| αvβ3 | ビトロネクチンレセプター | 上皮細胞、メラノーマ、グリオブラストーマ | ビトロネクチン、フィブロネクチン、Fbg、vWF、TSP、OPN、Cyr61、テネイシン、COMP、PECAM-1、BSP、ADAM-15、MMP、他 | 創傷治癒、血管新生、骨再生など | 増殖性糖尿病性網膜症、手足口病 |
| α6β4 | 角化細胞 | ラミニン | 上皮細胞におけるヘミデスモソーム形成 | ヘミデスモソーム型表皮水疱症 | |
| αvβ5 | 広範 | ビトロネクチン、OPN、BSP、LAP-TGFβ、CCN3 | 血管新生、上皮の再構築 | 増殖性糖尿病性網膜症 | |
| αvβ6 | 広範、特に肺や乳腺の上皮 | フィブロネクチン、OPN、LAP-TGFβ、ADAM | 上皮の形成、創傷治癒 | コクサッキーウイルス感染症 | |
| α4β7 | フィブロネクチン、OPN、MAdCAM-1, VCAM-1 | リンパ球のホーミング現象 | 炎症性腸疾患 | ||
| αEβ7 | E-カドヘリン | リンパ球のホーミング現象 | クローン病 | ||
| αvβ8 | 神経組織、末梢神経 | LAP-TGFβ | 神経突起伸長 | 不明 |
略号一覧。TSP:トロンボスポンジン、OPN:オステオポンチン、Fbg:フィブリノーゲン、vWF:フォンビルブランド因子、VCAM-1:vascular cell adhesion molecule-1、ICAM-1:intercellular adhesion molecule-1, MAdCAM-1:mucosal adressin cell adhesion molecule-1, ADAM:a disintegrin and metalloprotease, BSP:bone sialic protein, CCN3:an extracellular matrix protein, COMP:cartilage oligomeric matrix protein, Cyr61:cysteine-rich protein 61, L1: CD171, LAP-TGF-β: TGF-β latency-associated peptide, iC3b:inactivated complement component 3, PECAM-1:platelet and endothelial cell adhesion molecule 1, uPA:urokinase, uPAR:urokinase receptor, VEGF:vascular endothelial growth factor。
機能
編集インテグリンの機能は、細胞接着が基本である。細胞接着がベースになって、細胞伸展、細胞移動、細胞増殖、発生における組織形成、がんの転移、組織修復・血液凝固などの機能が発揮される。
- 細胞接着
- 細胞伸展
- 細胞移動
- 細胞増殖
- 発生における組織形成
- がんの転移
- 組織修復・血液凝固
細胞作用
編集細胞伸展でのインテグリンの作用がよく解析されている。
細胞の外からインテグリンに作用して、細胞機能を調節(例、細胞接着)する「アウトサイド-イン(outside-in signaling)」様式と、逆に細胞内の情報を細胞外に伝える「インサイド-アウト(inside-out signaling)」様式の2方向がある。
後者の例は、細胞分裂の時で、細胞が基質から離れ(接着が解除され)、細胞は丸くなり、細胞分裂する。細胞分裂が終わると、2つになった細胞は再び伸展し、基質に接着する。細胞分裂の時、細胞内の事情で、細胞接着が解除されるのである。
「アウトサイド-イン」様式のステップを説明しよう。
細胞表面のインテグリンは、基質上の細胞接着分子に結合すると活性化され、細胞表面上で多数会合する。インテグリンの会合化に伴って(あるいは会合化の結果)、細胞内タンパク質のリン酸化、細胞内のpH変化、Ca++の細胞内流入が起こる。この時、テーリン(talin)、キンドリン(kindlin)、ビンキュリン、αアクチニン、パキシリン、FAKなどのアダプタータンパク質が細胞膜裏打ち構造を形成する。さらに、カベオリンやGタンパク質共役型受容体(G protein coupled receptor: GPCR)なども関与し、タンパク質リン酸化を伴う複雑な細胞内シグナル伝達を展開する。
形態的には、インテグリンクラスター部分に接着斑(adhesion plaque)が形成され、ここを起点に細胞内のミクロフィラメント(アクチン線維)の配向が起こる。それらの結果(あるいは同時進行で)、細胞の接着、伸展、移動、分化、増殖が引き起こされる。
この節の加筆が望まれています。 |
がんの転移
編集がん細胞が原発巣から離れ、血液やリンパ系を介して移動し、身体の他の部分に到達し、そこで増殖する。この一連のステップをがんの転移というが、転移を防止できればがんの9割は治ると言われている。
転移の仕組みは、がん細胞が「原発巣から離れ」、体内を流れ、「標的組織に接着し」、標的組織を取り囲んでいる「細胞外マトリックスを分解し」、「浸潤し」、標的組織内で増殖する。
各ステップでの重要事項は、がん細胞と細胞外マトリックスとの接着(と接着解離)である。特に「 」で示した部分は接着あるいは接着解離そのものである。それで、多くのインテグリンががん細胞の転移に関与していると言われている。なお、インテグリンは細胞増殖にも関与するので、がん細胞の増殖にも関与する。
図5を説明しよう。ミュンヘン工科大学のHaubnerが開発中の腫瘍の画像診断法である。インテグリンαvβ3に特異的に結合するRDGペプチドに陽電子放出核種を標識した化合物・[18F]Galacto-RGDを作る。その化合物を取り込ませ、ポジトロン断層法で、転移能の高い悪性黒色腫のあるヒトのがん組織を、陽電子を放出する組織像として検出した。図5のがん組織に光る部分(矢印)があり、化合物・[18F]Galacto-RGD、つまり、インテグリンαvβ3が血管系に強く発現していることがわかる[24][25]。
遺伝子ノックアウト
編集特定のインテグリン遺伝子を人為的に欠損(ノックアウト)させたマウスを作り、そのマウスの症状を以下の表に示した。表に示すように、インテグリン遺伝子をノックアウトしても、致死でない場合が多い。生体内で機能していないのではなく、他の接着分子が代用するためと考えられている[26] [27]。
表の「致死・繁殖能」欄の略号は、「E:発生途中の死亡と死亡日、P:誕生前後に死亡、V:生存、F:繁殖能あり」を示す。
| 致死・繁殖能 | 症状 | |
|---|---|---|
| α1 | V、F | 明白な欠損なし。腫瘍の血管形成低下 |
| α2 | V、F | 明白な欠損すこしある。血小板凝集の遅れ。コラーゲンモノマーへの結合低下。乳腺分枝低下 |
| α3 | P | 腎細管欠損。肺分枝低下。皮膚の水泡。新皮質の層状化欠損 |
| α4 | E11/14 | 胎盤欠陥。心臓欠陥。 |
| α5 | E10-11 | 中胚葉と脈管発達に欠陥。神経冠アポトーシス。 |
| α6 | P | 皮膚に強い水泡。上皮組織の欠陥。目の層状化に欠陥 |
| α7 | V、F | 筋ジストロフィー。筋腱接合の欠陥 |
| α8 | P | 腎臓がないか小さい。内耳ヘアー細胞欠陥 |
| α9 | V | 誕生10日以内に死。リンパ管欠陥 |
| α10 | V、F | 骨の成長板に欠陥があり長骨発育不全 |
| α11 | 未報告? | |
| αD | V、F | T細胞の反応低下 |
| αE | V、F | 上皮内リンパ球の大幅減少 |
| αL | V、F | 白血球補充欠陥 |
| αM | V、F | 好中球の貪食とアポトーシスに欠陥。マスト細胞発達に欠陥。脂肪蓄積 |
| αX | 未報告? | |
| αⅡb | V、F | 出血。血小板無力症 |
| αv | E10/P | 胚の死は胎盤欠陥。出産前後の死は脳内血管欠陥 |
| β1 | E6.5 | 原腸胚形成不能 |
| β2 | V、F | 白血球接着不全症。炎症反応不全。皮膚感染。T細胞増殖不全 |
| β3 | V、F | 血小板無力症。出血。腫瘍内の過剰な血管増殖 |
| β4 | P | 表皮水疱症。上皮組織の欠陥 |
| β5 | V、F | 年齢に伴う失明の加速 |
| β6 | V、F | TGFβ活性化できず皮膚と気道の炎症。肺線維不全 |
| β7 | V | 腸リンパ不全。パイエル板なし |
| β8 | E10/P | 胚の死は胎盤欠陥。出産前後の死は脳内血管欠陥 |
疾患
編集インテグリン分子異常が原因で起こる疾患は、インテグリン「遺伝子ノックアウト」マウスの症状で推察できる。以下のヒトの3つの疾患は、インテグリン分子異常の常染色体劣性疾患である。
- 血小板無力症(Glanzmann’s thromboasthenia)・・・αⅡbβ3のα鎖またはβ鎖の遺伝子変異。血小板凝集因子が先天的に欠損した病気で、血小板による一次止血が遅れ、出血が止まりにくく、長くなる。
- 白血球接着不全症-Ⅰ型(Leukocyte adhesion deficiency typeⅠ、LAD-Ⅰ、別名、アンカー病 Anchor disease)・・・β2鎖の遺伝子変異(白血球接着不全症 - meddic)。好中球の接着能、遊走能、貪食能が低下し、細菌感染を受けやすくなる。
- 表皮水疱症(epidermolysis bullosa)の接合部型・ヘミデスモソーム型表皮水疱症・・・α6β4のα鎖またはβ鎖の遺伝子変異。皮膚や粘膜に水疱(水ぶくれ)やびらん(ただれ)ができる。日常生活での弱い外力でも簡単に水疱やびらんができる。
応用・特許
編集製品化された医薬品。
- アブシキマブ(レオプロ)(abciximab、ReoProR)・・・米国・セントコア社(Eli Lilly社?)が開発した血小板GPIIb/IIIaに対するヒト・マウスキメラ型モノクローナル抗体。血小板の凝集を阻害し血栓を作らないようにする抗血小板剤。日本ではまだ販売されていない(?)。
- エプチフィバチド(eptifibatide)・・・Millennium Pharmaceuticals社が製品化した血小板凝集抑制薬。GPIIb/IIIa受容体阻害。血小板の凝集を阻害し血栓を作らないようにする抗血小板剤。日本ではまだ販売されていない(?)。
- チロフィバン(tirofiban)・・・Medicure International社がAggrastatの商品名で製品化した血小板凝集抑制薬。GPIIb/IIIa受容体阻害。血小板の凝集を阻害し血栓を作らないようにする抗血小板剤。日本ではまだ販売されていない(?)。
この節の加筆が望まれています。 |
脚注・文献
編集- ^ Hynes RO (11 1973). “Alteration of cell-surface proteins by viral transformation and by proteolysis”. Proc Natl Acad Sci U S A 70 (11): 3170-3174. PMC 427194. PMID 4361679.
- ^ Yamada KM, Yamada SS, Pastan I. (4 1976). “Cell surface protein partially restores morphology, adhesiveness, and contact inhibition of movement to transformed fibroblasts”. Proc Natl Acad Sci U S A 73 (4): 1217-1221. PMC 430233. PMID 177979.
- ^ Sekiguchi K, Hakomori S. (5 1980). “Functional domain structure of fibronectin”. Proc Natl Acad Sci U S A 77 (5): 2661-2665. PMC 349462. PMID 6994104.
- ^ Hayashi M, Yamada KM (3 1983). “Domain structure of the carboxyl-terminal half of human plasma fibronectin”. J Biol Chem 258 (5): 3332-3340. PMID 6826564.
- ^ 公益財団法人 国際科学技術財団:日本国際賞/Japan Prize 2005年受賞者 エルキ・ルースラーティ(E. Ruoslahti)
- ^ Pierschbacher, M.D., Ruoslahti, E. (1984). “Cell attachment activity of fibronectin can be duplicated by small synthetic fragments of the molecule”. Nature 309: 30-33. doi:10.1038/309030a0.
- ^ Pytela R, Pierschbacher MD, Ruoslahti E. (1 1985). “Identification and isolation of a 140 kd cell surface glycoprotein with properties expected of a fibronectin receptor”. Cell 40 (1): 191-198. PMID 3155652.
- ^ Hasegawa T, Hasegawa E, Chen WT, Yamada KM (1985). “Characterization of a membrane-associated glycoprotein complex implicated in cell adhesion to fibronectin”. J Cell Biochem. 28 (4): 307-318. PMID 4055919.
- ^ Knudsen KA, Horwitz AF, Buck CA. (3 1985). “A monoclonal antibody identifies a glycoprotein complex involved in cell-substratum adhesion”. Exp Cell Res 157 (1): 218-226. PMID 2578969.
- ^ Tamkun JW, DeSimone DW, Fonda D, Patel RS, Buck C, Horwitz AF, Hynes RO (1986-7), “Structure of integrin, a glycoprotein involved in the transmembrane linkage between fibronectin and actin”, Cell 46 (2): 271-282, PMID 3487386
- ^ 林 正男、平野保英 (1983), “フィブロネクチンの構造と機能”, 蛋白質 核酸 酵素 28: 169-181
- ^ 長谷川孝幸、林 正男 (1986), “フィブロネクチンレセプターと細胞表面”, 蛋白質 核酸 酵素 31: 425-435
- ^ 林 正男、宮本泰則 (1999), “インテグリン研究の生い立ちと現状”, 蛋白質 核酸 酵素 44: 130-135
- ^ Suzuki S, Argraves WS, Pytela R, Arai H, Krusius T, Pierschbacher MD, Ruoslahti E. (11 1986). “cDNA and amino acid sequences of the cell adhesion protein receptor recognizing vitronectin reveal a transmembrane domain and homologies with other adhesion protein receptors”. Proc Natl Acad Sci U S A 83 (22): 8614-8618. PMC 386981. PMID 2430295.
- ^ Table of CD Antigens
- ^ CD list Protein Reviews On The Web
- ^ Takada Y, Huang C, Hemler ME (1987-4), “Fibronectin receptor structures in the VLA family of heterodimers”, Nature 326 (6113): 807-609, PMID 3031508
- ^ Pytela R, Pierschbacher MD, Ginsberg MH, Plow EF, Ruoslahti E (3 1986). “Platelet membrane glycoprotein IIb/IIIa: member of a family of Arg-Gly-Asp--specific adhesion receptors”. Science 231 (4745): 1559-1562. PMID 2420006.
- ^ Humphries M.J. (2000). “Integrin structure”. Biochem. Soc. Trans. 28 (4): 311-339. doi:10.1042/0300-5127:0280311. PMID 10961914.
- ^ Marsden M, Burke RD. (1 1997). “Cloning and characterization of novel beta integrin subunits from a sea urchin”. Dev Biol 181 (2): 234-245. PMID 9013933.
- ^ Sophie Cornillon, Leigh Gebbie, Mohammed Benghezal, Prashant Nair, Sebastien Keller, Bernhard Wehrle-Haller, Steve J Charette, Franz Bruckert, Francois Letourneur, and Pierre Cosson (6 2006). “An adhesion molecule in free-living Dictyostelium amoebae with integrin β features”. EMBO Rep 7 (6): 617-621. doi:10.1038/sj.embor.7400701. PMC 1479592.
- ^ “インテグリン”. 南山堂医学大辞典 (19th ed.). Tokyo: 南山堂. (2006). ISBN 978-4-525-01029-4
- ^ Yoshikazu Takada, Xiaojing Ye and Scott Simon (6 2007). “The integrins”. Genome Biol 8 (5): 215-. doi:10.1186/gb-2007-8-5-215. PMC 1929136.
- ^ Haubner R, Weber WA, Beer AJ, Vabuliene E, Reim D, et al. (3 2005). “Noninvasive Visualization of the Activated αvβ3 Integrin in Cancer Patients by Positron Emission Tomography and [18F]Galacto-RGD”. PLoS Med 2 (3): 0244-0255.
- ^ 吉本光喜 (2006). “RDGペプチドを利用した腫瘍イメージング”. 北陸地域アイソトープ研究会誌 (8): 27-30.
- ^ Yoshikazu Takada, Xiaojing Ye and Scott Simon (6 2007). “The integrins”. Genome Biol 8 (5): 215-. doi:10.1186/gb-2007-8-5-215. PMC 1929136.
- ^ Hynes RO (9 2002). “Integrins: bidirectional, allosteric signaling machines”. Cell 110 (6): 673-687. PMID 12297042.
全体の参考文献
編集- “インテグリン”. 南山堂医学大辞典 (19th ed.). Tokyo: 南山堂. (2006). ISBN 978-4-525-01029-4
- 林 正男 (2001). 新 細胞接着分子の世界. 東京: 羊土社. ISBN 9784897063270
- Hynes RO (9 2002). “Integrins: bidirectional, allosteric signaling machines”. Cell 110 (6): 673-687. PMID 12297042.
- Krieger M, Scott MP, Matsudaira PT, Lodish HF, Darnell JE, Zipursky L, Kaiser C, Berk A (2004). Molecular cell biology (5th ed.). New York: W.H. Freeman and CO. ISBN 0-7167-4366-3
- Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). “Integrins”. Molecular Biology of the Cell (4th ed.). New York: Garland Science. ISBN 0-8153-3218-1
外部リンク
編集- integrin - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
- Integrins - MBInfo 2013年7月26日閲覧
- Integrin, alpha Family | Cell Migration Knowledgebase 2013年7月26日閲覧
- Integrin, beta Family | Cell Migration Knowledgebase 2013年7月26日閲覧