ダパグリフロジン
ダパグリフロジン(Dapagliflozin)は2型糖尿病治療薬の内、SGLT-2阻害薬に分類される医薬品である。製品名はフォシーガ。(小野薬品工業販売、ブリストル・マイヤーズ製造、アストラゼネカコ・プロモーション)日本では2014年3月24日に製造承認された[1]。
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | フォシーガ |
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 78% |
| 血漿タンパク結合 | 91-92% |
| 代謝 | 肝および腎代謝 |
| 半減期 | 8.1-12.1時間 |
| 排泄 | 尿(75%), 糞便(21%) |
| 識別 | |
| CAS番号 |
461432-26-8 |
| ATCコード | A10BX09 (WHO) |
| PubChem | CID: 9887712 |
| ChemSpider |
8063384 |
| UNII |
1ULL0QJ8UC |
| KEGG |
D08897 |
| ChEMBL |
CHEMBL429910 |
| 別名 | BMS-512148 |
| 化学的データ | |
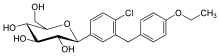
| 化学式 | C21H25ClO6 |
| 分子量 | 408.873 g/mol |
| |
適応
編集作用機序
編集SGLT(英: Sodium-Glucose Co-Transporter: ナトリウム依存性グルコース輸送担体)は、細胞表面に存在する膜タンパク質で、ナトリウムとブドウ糖の細胞内への共輸送をつかさどっている。SGLT-2は、SGLTのサブタイプの一つで腎臓近位尿細管に多く存在し、ブドウ糖の尿中からの再取り込みにおいて重要な役割を担っている(SGLT-1は小腸粘膜に多く存在し、食事からのブドウ糖の吸収を担っている)。ダパグリフロジンはこのSGLT-2を選択的に阻害することで、ナトリウムとブドウ糖の原尿中からの再取り込みを抑制し、ブドウ糖の尿中排泄を促進することで、血糖値を低下させる。インスリン非依存性に血糖降下作用を発揮し、高インスリン血症を来たさないため、インスリンの直接作用による副作用(低血糖、体重増加など)が発現しにくいことが期待されている。
臨床試験
編集治験段階では血糖低下以外に、血圧低下、血清尿酸値低下、コレステロールプロファイルの改善、体重減少も有意に認められた。体重減少効果は主に体液の減少ではなくカロリーの減少に関連するものである[4][5]。
2024年の二重盲検法ランダム化比較試験において、心不全の患者が服用することで、投与120日時点で死亡や入院による損失を0.9日、240日時点で2.3日、360日時点で4.8日減らせたとの報告がある [6]。 2024年の二重盲検法ランダム化比較試験では、急性心不全の患者に対して、利尿薬に併用することで、利尿効果を増強したとの報告がある [7]。
副作用
編集治験時には副作用は17.0%に見られ、その内訳は頻尿(3.6%)、口渇(1.8%)、性器感染症(1.7%)、尿路感染(1.7%)等であった。
添付文書に記載されている重大な副作用は、低血糖、腎盂腎炎、敗血症、脱水、ケトアシドーシスである[8]。血糖コントロール良好例でも脂肪酸代謝が亢進しケトアシドーシスが起こり得る。
手術後のケトアシドーシス発症リスクを軽減するため、FDAは当薬を手術予定日の少なくとも3日前に、中止することを推奨している[9]。
市販直後調査の中間報告で3例の死亡例が報告された[10]。いずれも服用開始から46日 - 約2カ月後で、死因等の詳細は不明または調査中。
体内動態
編集健常人および2型糖尿病患者を対象としたダパグリフロジンの単回投与漸増試験(SAD)および反復投与漸増試験(MAD)において、ダパグリフロジンの薬物動態が確認された。用量依存的な血中濃度の範囲で、Tmaxは1 - 2時間、半減期は約12 - 13時間で、蛋白結合型であり、吸収が速く腎臓からの排泄が少ない薬物であることが確認された[11]。
ダパグリフロジンの体内動態はBMIや体重による明らかな影響を受けないため、薬物動態学的知見はBMIの高い患者にも適用されると予想される。ダパグリフロジンの尿中グルコース排泄量は、単回投与で最大47g/dayと用量依存的に増加したが、 これはダパグリフロジンの作用機序から予想されることである[12]。
出典
編集- ^ アストラゼネカの広報資料
- ^ “「HFpEF」の新薬開発、SGLT-2阻害剤に期待 心不全治療、エントレストの主要項目未達で”. 日刊薬業(じほう). (2019年10月15日) 2019年10月15日閲覧。
- ^ a b “SGLT2阻害薬フォシーガのCOVID-19臨床試験を開始”. m3.com (2020年4月27日). 2020年5月2日閲覧。
- ^ Yang, Li; Li, Haiyan; Li, Hongmei; Bui, Anh; Chang, Ming; Liu, Xiaoni; Kasichayanula, Sreeneeranj; Griffen, Steven C. et al. (2013). “Pharmacokinetic and Pharmacodynamic Properties of Single- and Multiple-Dose of Dapagliflozin, a Selective Inhibitor of SGLT2, in Healthy Chinese Subjects”. Clinical Therapeutics 35 (8): 1211–1222.e2. doi:10.1016/J.Clinthera.2013.06.017. PMID 23910664.
- ^ Plosker, Greg L. (2012). “Dapagliflozin”. Drugs 72 (17): 2289–2312. doi:10.2165/11209910-000000000-00000. PMID 23170914.
- ^ “Dapagliflozin and Days of Full Health Lost in the DAPA-HF Trial”. J Am Coll Cardiol. 83 (20): 1973-1986.. (May 2024). doi:10.1016/j.jacc.2024.03.385.. PMID 38537918.
- ^ “Efficacy and Safety of Dapagliflozin in Patients With Acute Heart Failure.”. J Am Coll Cardiol. 83 (14): 1295-1306.. (April 2024). doi:10.1016/j.jacc.2024.02.009.. PMID 38569758.
- ^ “フォシーガ錠5mg/フォシーガ錠10mg 添付文書” (2015年9月). 2016年6月27日閲覧。
- ^ Research, Center for Drug Evaluation and (2022-03-15). “FDA revises labels of SGLT2 inhibitors for diabetes to include warnings about too much acid in the blood and serious urinary tract infections” (英語). FDA.
- ^ “SGLT2阻害薬の市販直後調査で5人の死亡例” (2014年10月17日). 2014年10月26日閲覧。
- ^ Bhartia, Mithun; Tahrani, Abd A.; Barnett, Anthony H. (2011). “SGLT-2 Inhibitors in Development for Type 2 Diabetes Treatment”. The Review of Diabetic Studies 8 (3): 348–354. doi:10.1900/RDS.2011.8.348. PMC 3280669. PMID 22262072.
- ^ Yang, Li; Li, Haiyan; Li, Hongmei; Bui, Anh; Chang, Ming; Liu, Xiaoni; Kasichayanula, Sreeneeranj; Griffen, Steven C. et al. (2013). “Pharmacokinetic and Pharmacodynamic Properties of Single- and Multiple-Dose of Dapagliflozin, a Selective Inhibitor of SGLT2, in Healthy Chinese Subjects”. Clinical Therapeutics 35 (8): 1211–1222.e2. doi:10.1016/J.Clinthera.2013.06.017. PMID 23910664.