細胞周期チェックポイント
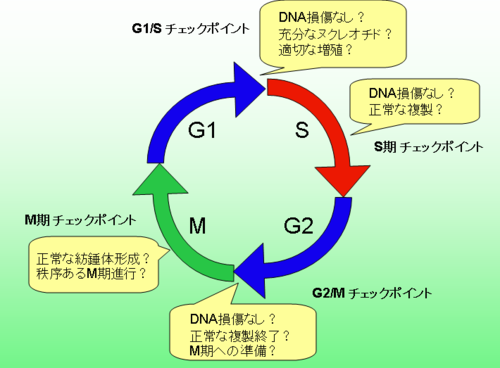
細胞周期チェックポイント(さいぼうしゅうきチェックポイント)とは、細胞が正しく細胞周期を進行させているかどうかを監視(チェック)し、異常や不具合がある場合には細胞周期進行を停止(もしくは減速)させる制御機構のことである。細胞自体がこの制御機構を備えている。一回の細胞分裂の周期の中に、複数のチェックポイントが存在することが知られており、これまでにG1/Sチェックポイント、S期チェックポイント、G2/Mチェックポイント、M期チェックポイントの4つが比較的よく解析されている。この機構は正確な遺伝情報を娘細胞、ひいては子孫に伝達するための、生命にとって根源的な役割を果たしていると考えられており、この機構の異常はヒトなどのがん発生の主要な原因のひとつといわれる。その基本概念は、1988年、リーランド・ハートウェルらにより提出された。
概要
編集細胞は、その性状や生体内での役割に応じて、それぞれ決まった周期で細胞分裂を繰り返し増殖している。この、一回の分裂増殖の周期を細胞周期と呼び、例えばいくつかの種類のヒト培養細胞の細胞周期は約24時間である。しかし、細胞にX線を照射してDNAに損傷を起こすと、この周期が長くなることが明らかになった。このメカニズムが研究された結果、細胞にはDNA損傷などの遺伝子異常が起きると、それを検知して細胞周期を一旦停止させる機構が存在することが発見され、この遺伝子異常を監視し細胞周期を止める機構は細胞周期チェックポイントと名付けられた。略してチェックポイントともいわれる。
細胞周期チェックポイントは、
などを監視しており、これらに異常が検知されると、チェックポイント制御因子と呼ばれる複数の分子群が活性化されて、細胞周期の進行を遅らせ、停止させる。
チェックポイント制御因子が活性化されると、その異常の原因が取り除かれるまで、細胞周期が停止した状態になる。この間に、例えば軽度のDNA損傷の場合には、DNA修復機構が働くことで損傷が修復される。そして異常が完全に取り除かれたと検知された時点で、チェックポイントの働きが可逆的に解除され、再び細胞周期が進行する。このように細胞周期チェックポイントは、細胞分裂の過程で異常が生じた場合に、細胞周期を一旦停止させて異常の原因を取り除くことで、遺伝子異常が子孫に伝わらないようにする役割を果たしていると考えられている。
また一方で、重度のDNA損傷の場合などDNA修復機構でも完全な修復が出来ない場合、チェックポイント活性化に続いて、その細胞がアポトーシスを起こして死滅することも明らかになった。この機構は、遺伝子異常を起こした細胞が「自殺」することで、異常な細胞を後世に残さないようする役割を果たしていると考えられている。細胞周期チェックポイントは、その細胞が損傷修復を経て再び増殖に向かうか、アポトーシスを起こすかというスイッチの制御にも関与していると考えられている。
チェックポイント機能に異常がおきると、内因性、外因性のDNA損傷によって、細胞は正確な娘細胞(コピー)を作れなくなる場合が多くなる。たとえば、チェックポイント機能の不良により生存に必須な遺伝子に損傷が起きた場合、その細胞は娘細胞を残せずにやがて死滅する。したがって、チェックポイント機能の異常は遺伝情報の正確な伝達において大きな不具合を持つことを意味し、生物にとって重大な脅威となりうる。実際にチェックポイント制御に関与するタンパク質群の変異が起きると、その細胞ではDNA損傷に対する感受性が増して、アポトーシスなどの細胞死を起こしやすくなる。
分類
編集細胞周期チェックポイントは、そのチェックポイントが細胞周期のどの段階(ステージ)に存在するかによって分類され、これまでに (1) G1/Sチェックポイント、(2) S期チェックポイント、(3) G2/Mチェックポイント、(4) M期チェックポイントの4つが比較的よく解析されている。これらはそれぞれ複数の、異なるチェックポイント制御関連分子によって制御されており、その制御機構は極めて複雑である。
G1/Sチェックポイント
編集G1期からS期に移行する際のチェックポイント。G1期DNAに損傷がないこと、これからのDNA複製のためのヌクレオチドなどが十分あること、細胞の大きさがチェックされる。多細胞生物では、増殖が許されているか(たとえば、サイトカインがあるか)、増殖が必要な細胞であるか、などもチェックされる。がん抑制遺伝子産物p53、RbとRbのホモログはこの制御を司っていると言われる。
この制御がDNA損傷などで活性化するとS期開始、すなわちDNA複製が阻害され、細胞はG1期にとどまる。酵母などで環境条件が良くない場合、または多細胞生物において細胞分裂が適当でない場合、G1停止が長く続くとG0期という休眠状態に入ることもある。G0期ではタンパク質合成が抑制され、細胞周期の進行に関わるタンパク質が一部分解される。
S期チェックポイント
編集S期のDNA複製の速さを制御し、DNA複製に不具合が検知された場合、複製を遅らせる機構。DNA損傷ではヒトのATM蛋白質はこの制御に関与していると言われる。
G2/Mチェックポイント
編集G2期からM期に移行する際のチェックポイント。この制御がDNA損傷などで活性化するとM期開始が阻害され、細胞はG2期にとどまる。DNA損傷応答においては、ATR(ataxia-telangiectasia mutated related)がそれ自身かあるいは他の因子によって損傷を認識した後にリン酸化を受け活性化されると、ATRはChk1をリン酸化して活性化する。活性型Chk1はCdc25Aのリン酸化を促進し[1]、Cdc25AによるCdc2の脱リン酸化を阻害するため、Cdc2は高リン酸化された不活性な状態に保たれ、M期に進行せずに細胞周期が停止する。また、活性化されたp53(遺伝子転写因子)は14-3-3s(シャペロン)を転写し、それがリン酸化Cdc25と結合し核外へ排出されるため、Cdc2が不活性なままになる。よってM期進行が抑制される。DNA損傷認識後のATRのリン酸化に関わっている因子は現時点でははっきりしていないが、ヒトがん抑制遺伝子産物BRCA1がその役割を担い、DNA損傷に応答したG2/Mチェックポイントの制御を司っているとも言われている。 DNA複製終了を待たずに、M期が開始する酵母変異株を考慮すると、監視(チェック)期間はS期からG2期にわたる比較的長い期間であると考えられる。
M期チェックポイント
編集M期(有糸分裂期)の途中にあるチェックポイントで、スピンドルチェックが行われる。M期の細胞では、G2期までのステップで複製された対を成す染色分体が、互いにセントロメア付近でコヒーシン複合体によって架橋結合し、また、このコヒーシンを切断するタンパク分解酵素セパラーゼがセキュリンと結合することで不活性化された状態で存在する。
有糸分裂過程の次のステップとして、細胞の両極から伸びる紡錘糸(微小管)が、それぞれの染色分体のキネトコア(セントロメアの一部)に結合する。一対の染色分体が対称になるよう、正しくかつ同時に、紡錘糸を介して細胞の両極に結合しているかどうかがチェックされる(分裂時の染色体の挙動については、染色体の項も参照)。
分裂後期の染色分体の移動に際しては、ユビキチンリガーゼであるAPC/CがCdc20と結合して活性化することが必要となる。紡錘体が正く形成されると、Cdc20の阻害タンパクであるMad2がCdc20との結合から外れ、APC/Cと結合する。活性化したAPC/Cによって、セキュリン蛋白がユビキチン化され、プロテアソーム依存的に分解されることでセパラーゼが活性化し、染色分体間を架橋するコヒーシン蛋白が切断される。これにより、染色分体は紡錘体極へと移動が可能となる。染色分体が両極から伸びた微小管と等しく結合していないうちは、オーロラキナーゼなどのスピンドルチェックポイントタンパクの監視によってAPC/Cの活性化が阻害され、染色分体の分離を抑制する。
がんと遺伝的不安定性への関連
編集以下のことから、細胞周期チェックポイント制御の部分的破綻はがんの発生と進行(すなわち細胞の無制御な異常増殖)の大きなひとつの要因ではないかと推測されている。
脚注
編集- ^ Mei-Shya Chen, Christine E. Ryan, and Helen Piwnica-Worms, Chk1 Kinase Negatively Regulates Mitotic Function of Cdc25A Phosphatase through 14-3-3 Binding, Mol Cel Biol(2003), 23, 7488-7497