三フッ化塩素
| 三フッ化塩素 | |
|---|---|
| |
| 組成式 | ClF3 |
| 式量 | 92.45 g/mol |
| 形状 | 気体 |
| CAS登録番号 | 7790-91-2 |
| 密度と相 | 0.0041 g/cm3, 気体 |
| 融点 | −76.3 °C |
| 沸点 | 11.8 °C |
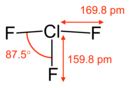
三フッ化塩素(さんフッかえんそ)は、化学式 ClF3 で表される塩素とフッ素の化合物である。気体または淡黄色の液体で、有毒。1912年、溶融 NaCl/HF の電気分解によって初めて作られた。現在では 3% 次亜塩素酸ナトリウム溶液とフッ素ガスを反応させることによって作られる。
純粋ならばガラス容器中 180 ℃ まで安定だが、それ以上の温度ではフリーラジカル機構で分解する。
非常に強い酸化剤、フッ素化剤である。金属との反応では塩化物とフッ化物、リンとの反応では三塩化リン (PCl3) と五フッ化リン (PF5)、硫黄との反応では二塩化硫黄 (SCl2) と四フッ化硫黄 (SF4) を、それぞれ与える。室温で硫化水素 (H2S) と混合すると爆発する。
軍事的利用
編集ナチス・ドイツ下のカイザー・ヴィルヘルム研究所で暗号名 N-stoff (基質 N)として軍事的応用が検討された。第二次世界大戦より少し前のことである。マジノ線要塞の実物大模型に対して実験が行われ、焼夷兵器や毒ガスとして有効なことが明らかにされた。1938年からファルケンハーゲン (Falkenhagen) で 3,176 ヘクタールの敷地面積を持つ地下秘密兵站工廠の建設が始まり、月に50トンの N-stoff およびサリンの製造が予定された。しかし、1944年に進駐してきた赤軍に奪われるまでおよそ30から50トンしか製造されておらず、1キログラム当たり100ライヒスマルク以上の費用がかかった計算になる。N-stoff が戦争で実際に使用されることはなかった[1]。
現在でも焼夷ガスは実用化していない。製造コストの高さ、保管や輸送の取扱いの難しさ、散布後の自然減衰が激しく効果時間が短い、 などの多くの欠点を解決する目処が立たないためである。
参考文献
編集関連項目
編集| ハロゲン間化合物 | |||||
|---|---|---|---|---|---|
| フッ素 | 塩素 | 臭素 | ヨウ素 | アスタチン | |
| フッ素 | F2 | ||||
| 塩素 | ClF ClF3 ClF5 | Cl2 | |||
| 臭素 | BrF BrF3 BrF5 | BrCl BrCl3 | Br2 | ||
| ヨウ素 | IF IF3 IF5 IF7 | ICl I2Cl6 | IBr IBr3 | I2 | |
| アスタチン | AtCl | AtBr | AtI | At2? | |
