モリブドプテリン
モリブドプテリン(Molybdopterin)は補因子の一つ。モリブデンを含むほとんどの酵素とタングステンを含む全ての酵素に見られる。MPT、ピラノプテリンジチオラートとも呼ばれる。ややこしいが、モリブドプテリンは金属原子に結合するプテリン配位子に与えられた名称であり、それ自体はモリブデンを含まない。モリブデンと結合した完全な化合物は通常モリブデン補因子と呼ばれる。
| モリブドプテリン | |
|---|---|

| |
| 識別情報 | |
| CAS登録番号 | 73508-07-3 |
| PubChem | 135402014 |
| MeSH | molybdopterin |
| |
| 特性 | |
| 化学式 | C10H10N5O6PS2 + R groups |
| モル質量 | 394.33 g/mol (R=H) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
モリブドプテリンの骨格であるピラノプテリンは、プテリン環とピラン環が縮環した複素環式化合物である。ピラン環には金属に配位する2個のチオールに加えアルキルリン酸基が付加しているが、アルキルリン酸基はアルキルリン酸ヌクレオチドになる場合もある。モリブドプテリンを含む酵素にはキサンチンオキシダーゼ、DMSOレダクターゼ、亜硫酸オキシダーゼ、硝酸レダクターゼ等がある。
モリブドプテリンを用いないモリブデン含有酵素はニトロゲナーゼのみである。この酵素はモリブドプテリンとはかなり異なる鉄硫黄中心の一部としてモリブデンを含む[5]。
生合成
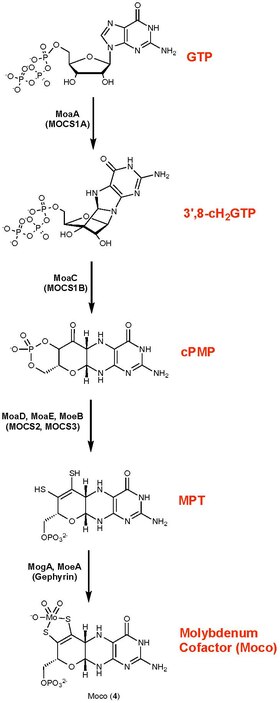
編集他の多くの補因子と異なり、モリブデン補因子 (Moco) は食物から摂取することができないためデノボ合成する必要がある。生合成は以下の4段階で起こる[6][7]。
- (i) グアノシン三リン酸 (GTP) からラジカル活性化を経て(8S)‑3',8‐シクロ‑7,8‑ジヒドログアノシン 5'‑三リン酸 (3',8‑cH2GTP) への環化
- (ii) 3',8‑cH2GTPからの環状ピラノプテリン一リン酸 (cPMP) の形成
- (iii) cPMPからモリブドプテリン (MPT) への変換
- (iv) MPTへのモリブデン酸の挿入とMocoの形成
まず、2段階の酵素反応を経てグアノシン三リン酸が環状ピラノプテリン一リン酸に変換される。この酵素の一つはC—X (X = S, N) 結合形成反応にしばしば関与する酵素ファミリーであるラジカルSAMに属する[8][7][6]。このピラノプテリン中間体をモリブドプテリンに変換するにはさらに3段階の酵素反応が必要である。変換後にはエンジチオラートが生成するが、硫黄上の置換基は不明である。硫黄はシステインパースルフィドを経由し、鉄硫黄タンパク質の生合成に類似した過程で取り込まれる。モリブデンまたはタングステンが組み込まれる段階で、一リン酸部分にADPが結合しアデニル化される。金属原子はオキソアニオンであるモリブデン酸やタングステン酸の形態で取り込まれる。
キサンチンオキシダーゼでは1分子のモリブドプテリンに1原子のモリブデンが結合するが、DMSOレダクターゼのように2分子のモリブドプテリンに1原子のモリブデンが結合する場合もある[9]。
タングステン誘導体
編集細菌の酸化還元酵素の中には、タングステンをモリブデンと同様のモリブドプテリン錯体として用いるものがある。一般的に、タングステン含有酵素は遊離カルボン酸をアルデヒドへと還元するものである[11]。
最初に発見されたタングステン含有酵素にはセレンも含まれることが分かっており、タングステン-セレンのペアはモリブデン含有酵素に見られるモリブデン-硫黄のペアと同様に機能すると推測されている[12]。細菌由来のタングステン含有キサンチンデヒドロゲナーゼにはタンパク質と結合していないセレンが含まれる(つまりセレノシステインやセレノメチオニンではない)と分かっているが、タングステン-セレン複合体の正確な構造は未だ不明である[13]。
モリブドプテリンを用いる酵素
編集関連項目
編集参考文献
編集- ^ “HPEUEJRPDGMIMY-UHFFFAOYSA-N” (英語). pubchem.ncbi.nlm.nih.gov. 4 February 2019閲覧。 “IUPAC Name [2-amino-4-oxo-6,7-bis(sulfanyl)-3,5,5~{a},8,9~{a},10-hexahydropyrano[3,2-g]pteridin-8-yl]methyl dihydrogen phosphate”
- ^ “[2-Amino-4-oxo-6,7-bis(sulfanyl)-3,5,5a,8,9a,10-hexahydropyrano[3,2-gpteridin-8-yl]methyl dihydrogen phosphate]” (英語). pubchem.ncbi.nlm.nih.gov. 4 February 2019閲覧。 “InChI=1S/C10H14N5O6PS2/c11-10-14-7-4(8(16)15-10)12-3-6(24)5(23)2(21-9(3)13-7)1-20-22(17,18)19/h2-3,9,12,23-24H,1H2,(H2,17,18,19)(H4,11,13,14,15,16)”
- ^ “HPEUEJRPDGMIMY-UHFFFAOYSA-N” (英語). pubchem.ncbi.nlm.nih.gov. 4 February 2019閲覧。 “InChI Key HPEUEJRPDGMIMY-UHFFFAOYSA-N”
- ^ “HPEUEJRPDGMIMY-UHFFFAOYSA-N” (英語). pubchem.ncbi.nlm.nih.gov. 4 February 2019閲覧。 “InChI InChI=1S/C10H14N5O6PS2/c11-10-14-7-4(8(16)15-10)12-3-6(24)5(23)2(21-9(3)13-7)1-20-22(17,18)19/h2-3,9,12,23-24H,1H2,(H2,17,18,19)(H4,11,13,14,15,16)”
- ^ a b Structure, synthesis, empirical formula for the di-sulfhydryl. Archived 2016-06-04 at the Wayback Machine. Accessed Nov. 16, 2009.
- ^ a b “Mechanism of pyranopterin ring formation in molybdenum cofactor biosynthesis”. Proc Natl Acad Sci USA 112 (20): 6347–52. (May 2015). Bibcode: 2015PNAS..112.6347H. doi:10.1073/pnas.1500697112. PMC 4443348. PMID 25941396.
- ^ a b “Identification of a cyclic nucleotide as a cryptic intermediate in molybdenum cofactor biosynthesis”. J Am Chem Soc 135 (18): 7019–32. (April 2013). doi:10.1021/ja401781t. PMC 3777439. PMID 23627491.
- ^ Mendel, R. R.; Leimkuehler, S. (2015). “The biosynthesis of the molybdenum cofactors”. JBIC, J. Biol. Inorg. Chem. 20 (2): 337–347. doi:10.1007/s00775-014-1173-y. PMID 24980677.
- ^ Schwarz, G. & Mendel, R. R. (2006). “Molybdenum cofactor biosynthesis and molybdenum enzymes”. Annual Review of Plant Biology 57: 623–647. doi:10.1146/annurev.arplant.57.032905.105437. PMID 16669776.
- ^ Kisker, C.; Schindelin, H.; Baas, D.; Rétey, J.; Meckenstock, R.U.; Kroneck, P.M.H. (1999). “A structural comparison of molybdenum cofactor-containing enzymes”. FEMS Microbiol. Rev. 22 (5): 503–521. doi:10.1111/j.1574-6976.1998.tb00384.x. PMID 9990727.
- ^ Lassner, Erik (1999). Tungsten: Properties, Chemistry, Technology of the Element, Alloys and Chemical Compounds. Springer. pp. 409–411. ISBN 978-0-306-45053-2
- ^ Stiefel, E. I. (1998). “Transition metal sulfur chemistry and its relevance to molybdenum and tungsten enzymes”. Pure Appl. Chem. 70 (4): 889–896. doi:10.1351/pac199870040889.
- ^ “Selenium-containing xanthine dehydrogenase from Eubacterium barkeri”. Eur. J. Biochem. 264 (3): 862–71. (September 1999). doi:10.1046/j.1432-1327.1999.00678.x. PMID 10491134.