マトリックスメタロプロテイナーゼ-2
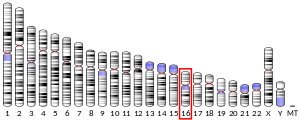
マトリックスメタロプロテイナーゼ-2(英: matrix metalloproteinase-2、略称: MMP-2)、または72 kDa IV型コラゲナーゼ(英: 72 kDa type IV collagenase)、ゼラチナーゼA(英: gelatinase A)は、ヒトではMMP2遺伝子にコードされる酵素である[5]。MMP2遺伝子は、16番染色体のq12.2に位置する[6]。
機能
編集MMP-2はマトリックスメタロプロテイナーゼ(MMP)ファミリーに属する。このファミリーのタンパク質は、細胞外マトリックス(ECM)の構成要素やシグナル伝達に関与する分子を切断する亜鉛依存性酵素である。触媒ドメインには3つのフィブロネクチンII型リピートが含まれ、変性したIV型・V型コラーゲンやエラスチンへの結合を可能にしている。MMPファミリーの大部分とは異なり、このタンパク質の活性化は細胞膜上で生じる。細胞外でのプロテアーゼによる活性化のほか、細胞内ではS-グルタチオン化によってプロドメインの除去を必要とせずに活性化される。このタンパク質は、神経系の機能、月経時の子宮内膜の剥離、脈管形成の調節、転移など複数の経路に関与していると考えられている。MMP2遺伝子の変異はウィンチェスター症候群や骨溶解症-結節症-関節症症候群と関係している[7]。
活性化
編集タンパク質切断によるMMP-2の活性化過程においては、MT1-MMPとTIMP2からなる複合体によってMMP-2前駆体が細胞外環境から細胞表面へリクルートされる。より具体的には、まずプロテアーゼ活性を有するMT1-MMP二量体に対してインヒビターであるTIMP2が結合する。この複合体中のTIMP2にMMP-2前駆体が結合することでMMP-2前駆体はMT1-MMPによる触媒反応に適した位置に配置され、切断と活性化が行われる[8]。
臨床的意義
編集MMP2遺伝子の変異は、Torg-Winchester症候群、多中心性骨溶解症や関節炎と関係している[9][10]。
慢性疾患における役割
編集他のゼラチナーゼ(MMP-9)とのMMP-2の相対活性は、特発性間質性肺炎や気管支拡張症などの慢性気道疾患の重症度と関連している。特発性間質性肺炎においては、MMP-2活性が上昇している患者は比較的重症度が低く、副腎皮質ホルモン剤治療への応答性が高い[11]。非嚢胞性線維症気管支拡張症では、緑膿菌Pseudomonas aeruginosa感染患者と比較してインフルエンザ菌Haemophilus influenzae感染患者でMMP-2濃度が上昇している[12]。緑膿菌感染を有する気管支拡張症患者では、より迅速な肺機能低下がみられる[13]。
MMP2遺伝子の変異は、稀な骨異形成症である多中心性骨溶解症-結節症-関節症(MONA)の原因となる。変異はコラーゲンのリモデリングの欠陥をもたらし、特に手首・足首の骨の破壊、全身性の骨粗鬆症、関節の硬直と最終的には破壊といった症状が生じる[10][14]。
がん
編集MMPの発現レベルや活性レベルの変化は、多くのがんのプログレッションや転移に関与している可能性が強く示唆されている。MMP-2活性の上昇は、大腸がん、メラノーマ、乳がん、肺がん、卵巣がん、前立腺がんなど複数のがんで予後不良と関連づけられている[15]。MMP-2活性の変化は、転写、分泌、活性化や阻害の変化が原因となっている場合がある。多くのがんにおいて、MMPの産生は腫瘍病変よりも周囲の間質組織でアップレギュレーションが生じている可能性がある。一例として大腸がんでは、MMP2のmRNA濃度は転移性病変と非転移性病変で同等であるもの、転移性症例は周囲の健全な組織でのMMP2のmRNAの発現レベルの高さと関係している[16]。
がんの浸潤における役割
編集MMPががんのプログレッション関係しているのはECMを分解する役割を介してであり、それによってがん細胞は原発巣を出て転移巣を形成することができるようになる。より具体的にはMMP-2は(MMP-9とともに)、基底膜に最も豊富に存在する構成要素であるIV型コラーゲンを分解することができる。基底膜は組織の構成の維持、細胞の構造的支持、細胞シグナル伝達や極性への影響に重要な役割を果たしており、基底膜の分解は大部分のがんにおいて転移に必要不可欠の段階である[16]。
がん細胞の浸潤、ECMの分解、そして転移は、がん細胞上の突起状の接着構造である浸潤突起の存在ときわめて密接に関連している。浸潤突起にはMMP(MT1-MMP、MMP-2、MMP-9など)が濃縮されており、局所的な放出と活性化が行われていることが示されている[17]。さらに、MMP活性による分解産物は浸潤突起の形成をさらに促進し、MMPの活性を高めている可能性がある[18]。MMP-2や他のいくつかのMMPはTGF-βをタンパク質分解によって活性化しする。TGF-βは、がんの転移に関する重要な過程である上皮間葉転換を促進していることが示されている[19]。
シグナル伝達における役割
編集MMPによるECMの分解は、ECMによって保持されていた成長因子の放出、ECM分解産物の生成、ECM分子内の隠れた結合部位の露出、といった機構によって細胞の挙動に影響を及ぼす[20]。一例として、MMP-2によるI型コラーゲンの分解は、これまでアクセスできない状態であった隠れた結合部位を露出させ、ヒトメラノーマ細胞が発現しているαvβ3インテグリンとの結合をもたらす。このインテグリンを介したシグナル伝達は、コラーゲンマトリックス内でのメラノーマ細胞の生存と成長に必要であり、細胞をアポトーシスから防いでいる可能性がある[21]。他の例としては、基底膜の構成要素であるラミニン-5のMMP-2による切断は、乳腺上皮細胞の遊走を誘導する隠れた結合部位を露出させることが示されている[22]。
より一般的には、MMPはECMを分解することでECMに結合していた成長因子の放出を引き起こし、それらが細胞表面受容体に結合することで細胞シグナル伝達に影響を及ぼす。さらに、多くのMMPは他のMMP前駆体や成長因子の活性化も行う[20]。MMP-2の場合、ECM以外にもTGF-β、FGFR1、TNF前駆体、IL-1βやさまざまなケモカインを切断することが示されている[23]。MMP-2はMMP-9とともに潜在型TGF-βの切断に関与していることが示唆されている。TGF-βはがん細胞と複雑な相互作用を行うが、一般的には組織の恒常性を維持し、腫瘍のプログレッションを防止する役割を果たしている。しかしながら、遺伝的に不安定ながん細胞はTGF-β受容体を変化させることでTGF-βによる調節を回避していることが多い。さらに、TGF-βの発現は免疫寛容とも相関しており、がん細胞が免疫調節を回避するのに役立っている可能性がある[24]。
血管新生とリンパ管新生における役割
編集MMP-2は腫瘍内での新血管の形成(血管新生)においても重要な役割を果たしている。腫瘍は成長するにつれて必要とする酸素や栄養素の量は多くなるため、血管新生は腫瘍のプログレッションに必要不可欠である。MMP-2の局所的活性化は、血管新生の重要な特徴である内皮細胞の遊走に重要な役割を果たしている。さらに、MMP-9や他のMMPも、血管新生においてVEGFの動員の促進や抗血管新生因子の産生など、複雑かつ間接的な役割を果たしていることが示唆されている[16]。
一例として、トランスジェニックマウスを用いた膵島での発がんの研究では、血管新生病変部位ではMMP-2やMMP-9がアップレギュレーションされており、これらのMMPのアップレギュレーションが血管新生の強力な刺激因子であるVEGFの放出の引き金となっていることが示されている。また、MMP-2ノックアウトマウスでは野生型マウスと比較して腫瘍成長速度が低下する[25]。さらに、MMP-2の発現や活性の増大は中枢神経系へ転移した肺がんでの血管形成の増加と関連づけられており、こうした転移巣の生存率を高めている可能性が高い[26]。
MMP-2はリンパ管新生を駆動することも示されている。多くの場合腫瘍環境ではリンパ管新生が過剰となり、がん細胞の転移経路となっている場合がある。ゼブラフィッシュでは、mmp2のノックダウンによって血管新生に影響を及ぼすことなくリンパ管形成が阻害され、MMP-2の阻害によってリンパ管内皮細胞の遊走が遅れて新たに形成されるリンパ管の形態が変化することが示されている[16]。これらの結果は、MMP-2は血管新生に加えてリンパ管新生を調節することで腫瘍の生存や浸潤に影響を及ぼしている可能性を示唆している。
がん治療としてのMMP-2の阻害
編集MMP阻害剤を用いたがん治療の臨床試験は、概して良好な結果は得られていない。組織形成やがんのプログレッションにおいてMMPは複雑な役割を果たしており、多くのMMPが腫瘍形成を促進する性質と抑制する性質の双方を有していることが、こうした結果の原因となっていると考えられている。さらに、多くの臨床試験には進行したステージのがんも含まれており、こうしたケースではMMP阻害剤は特に有効性が低い。また、MMP阻害剤の効力を測定するための信頼性の高いバイオマーカーが存在せず、そしてMMPは直接的な細胞傷害性を示すわけではない(MMPは腫瘍の縮小を引き起こすわけではない)。こうした理由により、阻害剤が標的に到達しているかどうかを明確に示すことも困難である[15]。しかしながら、広域MMP阻害剤を用いた初期段階の臨床研究では一部で良好な結果が得られている。第I相臨床試験では、MMP阻害剤は一般的に安全性が高く、有害な副作用が極めて少ないことが示されている。マリマスタットを用いた試験では、胃がんまたは膵がんの患者の生存にわずかな改善が示されている[15]。
相互作用
編集MMP-2は次に挙げる因子と相互作用することが示されている。
出典
編集- ^ a b c GRCh38: Ensembl release 89: ENSG00000087245 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000031740 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ Devarajan P, Johnston JJ, Ginsberg SS, Van Wart HE, Berliner N (December 1992). “Structure and expression of neutrophil gelatinase cDNA. Identity with type IV collagenase from HT1080 cells”. J. Biol. Chem. 267 (35): 25228–32. doi:10.1016/S0021-9258(19)74029-0. PMID 1460022.
- ^ “MMP2 gene”. Genetics Home Reference. 2015年5月19日閲覧。
- ^ “MMP2 matrix metallopeptidase 2 [Homo sapiens (human) - Gene - NCBI]” (英語). www.ncbi.nlm.nih.gov. 2024年3月25日閲覧。
- ^ Itoh, Yoshifumi; Seiki, Motoharu (2004-06). “MT1-MMP: an enzyme with multidimensional regulation”. Trends in Biochemical Sciences 29 (6): 285–289. doi:10.1016/j.tibs.2004.04.001. ISSN 0968-0004. PMID 15276180.
- ^ Martignetti JA, Aqeel AA, Sewairi WA, Boumah CE, Kambouris M, Mayouf SA, Sheth KV, Eid WA, Dowling O, Harris J, Glucksman MJ, Bahabri S, Meyer BF, Desnick RJ (July 2001). “Mutation of the matrix metalloproteinase 2 gene (MMP2) causes a multicentric osteolysis and arthritis syndrome”. Nature Genetics 28 (3): 261–5. doi:10.1038/90100. PMID 11431697.
- ^ a b Elsebaie H, Mansour MA, Elsayed SM, Mahmoud S, El-Sobky TA (December 2021). “Multicentric Osteolysis, Nodulosis, and Arthropathy in two unrelated children with matrix metalloproteinase 2 variants: Genetic-skeletal correlations”. Bone Reports 15: 101106. doi:10.1016/j.bonr.2021.101106. PMC 8283316. PMID 34307793.
- ^ Suga M, Iyonaga K, Okamoto T, Gushima Y, Miyakawa H, Akaike T, Ando M (November 2000). “Characteristic elevation of matrix metalloproteinase activity in idiopathic interstitial pneumonias”. American Journal of Respiratory and Critical Care Medicine 162 (5): 1949–56. doi:10.1164/ajrccm.162.5.9906096. PMID 11069839.
- ^ Taylor SL, Rogers GB, Chen AC, Burr LD, McGuckin MA, Serisier DJ (May 2015). “Matrix metalloproteinases vary with airway microbiota composition and lung function in non-cystic fibrosis bronchiectasis”. Annals of the American Thoracic Society 12 (5): 701–7. doi:10.1513/AnnalsATS.201411-513OC. PMID 25679336.
- ^ Rogers GB, Zain NM, Bruce KD, Burr LD, Chen AC, Rivett DW, McGuckin MA, Serisier DJ (May 2014). “A novel microbiota stratification system predicts future exacerbations in bronchiectasis”. Annals of the American Thoracic Society 11 (4): 496–503. doi:10.1513/AnnalsATS.201310-335OC. PMID 24592925.
- ^ Bhavani GS, Shah H, Shukla A, Gupta N, Gowrishankar K, Rao AP, Kabra M, Agarwal M, Ranganath P, Ekbote AV, Phadke SR, Kamath A, Dalal A, Girisha KM (February 2016). “Clinical and mutation profile of multicentric osteolysis nodulosis and arthropathy”. American Journal of Medical Genetics. Part A 170A (2): 410–417. doi:10.1002/ajmg.a.37447. PMID 26601801.
- ^ a b c Björklund M, Koivunen E (May 2005). “Gelatinase-mediated migration and invasion of cancer cells”. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer 1755 (1): 37–69. doi:10.1016/j.bbcan.2005.03.001. hdl:10138/22049. PMID 15907591.
- ^ a b c d Mook OR, Frederiks WM, Van Noorden CJ (December 2004). “The role of gelatinases in colorectal cancer progression and metastasis”. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer 1705 (2): 69–89. doi:10.1016/j.bbcan.2004.09.006. PMID 15588763.
- ^ Jacob A, Prekeris R (2015). “The regulation of MMP targeting to invadopodia during cancer metastasis”. Frontiers in Cell and Developmental Biology 3: 4. doi:10.3389/fcell.2015.00004. PMC 4313772. PMID 25699257.
- ^ Clark ES, Whigham AS, Yarbrough WG, Weaver AM (May 2007). “Cortactin is an essential regulator of matrix metalloproteinase secretion and extracellular matrix degradation in invadopodia”. Cancer Research 67 (9): 4227–35. doi:10.1158/0008-5472.CAN-06-3928. PMID 17483334.
- ^ Gialeli C, Theocharis AD, Karamanos NK (Jan 2011). “Roles of matrix metalloproteinases in cancer progression and their pharmacological targeting”. The FEBS Journal 278 (1): 16–27. doi:10.1111/j.1742-4658.2010.07919.x. PMID 21087457.
- ^ a b McCawley LJ, Matrisian LM (April 2000). “Matrix metalloproteinases: multifunctional contributors to tumor progression”. Molecular Medicine Today 6 (4): 149–56. doi:10.1016/s1357-4310(00)01686-5. PMID 10740253.
- ^ Montgomery AM, Reisfeld RA, Cheresh DA (September 1994). “Integrin alpha v beta 3 rescues melanoma cells from apoptosis in three-dimensional dermal collagen”. Proceedings of the National Academy of Sciences of the United States of America 91 (19): 8856–60. Bibcode: 1994PNAS...91.8856M. doi:10.1073/pnas.91.19.8856. PMC 44705. PMID 7522323.
- ^ Giannelli G, Falk-Marzillier J, Schiraldi O, Stetler-Stevenson WG, Quaranta V (July 1997). “Induction of cell migration by matrix metalloprotease-2 cleavage of laminin-5”. Science 277 (5323): 225–28. doi:10.1126/science.277.5323.225. PMID 9211848.
- ^ Detry B, Erpicum C, Paupert J, Blacher S, Maillard C, Bruyère F, Pendeville H, Remacle T, Lambert V, Balsat C, Ormenese S, Lamaye F, Janssens E, Moons L, Cataldo D, Kridelka F, Carmeliet P, Thiry M, Foidart JM, Struman I, Noël A (May 2012). "Matrix metalloproteinase-2 governs lymphatic vessel formation as an interstitial collagenase". Blood. 119 (21): 5048–56. doi:10.1182/blood-2011-12-400267. PMID 22490679。
- ^ Massagué J (July 2008). “TGFbeta in Cancer”. Cell 134 (2): 215–30. doi:10.1016/j.cell.2008.07.001. PMC 3512574. PMID 18662538.
- ^ Bergers G, Brekken R, McMahon G, Vu TH, Itoh T, Tamaki K, Tanzawa K, Thorpe P, Itohara S, Werb Z, Hanahan D (October 2000). “Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis”. Nature Cell Biology 2 (10): 737–44. doi:10.1038/35036374. PMC 2852586. PMID 11025665.
- ^ Rojiani MV, Alidina J, Esposito N, Rojiani AM (2010). “Expression of MMP-2 correlates with increased angiogenesis in CNS metastasis of lung carcinoma”. International Journal of Clinical and Experimental Pathology 3 (8): 775–81. PMC 2993228. PMID 21151391.
- ^ McQuibban GA, Gong JH, Tam EM, McCulloch CA, Clark-Lewis I, Overall CM (August 2000). “Inflammation dampened by gelatinase A cleavage of monocyte chemoattractant protein-3”. Science 289 (5482): 1202–6. Bibcode: 2000Sci...289.1202M. doi:10.1126/science.289.5482.1202. PMID 10947989.
- ^ a b Bein K, Simons M (October 2000). “Thrombospondin type 1 repeats interact with matrix metalloproteinase 2. Regulation of metalloproteinase activity”. J. Biol. Chem. 275 (41): 32167–73. doi:10.1074/jbc.M003834200. PMID 10900205.
- ^ Morgunova E, Tuuttila A, Bergmann U, Tryggvason K (May 2002). “Structural insight into the complex formation of latent matrix metalloproteinase 2 with tissue inhibitor of metalloproteinase 2”. Proc. Natl. Acad. Sci. U.S.A. 99 (11): 7414–9. Bibcode: 2002PNAS...99.7414M. doi:10.1073/pnas.102185399. PMC 124245. PMID 12032297.
- ^ Overall CM, Tam E, McQuibban GA, Morrison C, Wallon UM, Bigg HF, King AE, Roberts CR (December 2000). “Domain interactions in the gelatinase A.TIMP-2.MT1-MMP activation complex. The ectodomain of the 44-kDa form of membrane type-1 matrix metalloproteinase does not modulate gelatinase A activation”. J. Biol. Chem. 275 (50): 39497–506. doi:10.1074/jbc.M005932200. PMID 10991943.
- ^ a b Bigg HF, Shi YE, Liu YE, Steffensen B, Overall CM (June 1997). “Specific, high affinity binding of tissue inhibitor of metalloproteinases-4 (TIMP-4) to the COOH-terminal hemopexin-like domain of human gelatinase A. TIMP-4 binds progelatinase A and the COOH-terminal domain in a similar manner to TIMP-2”. J. Biol. Chem. 272 (24): 15496–500. doi:10.1074/jbc.272.24.15496. PMID 9182583.
- ^ a b Kai HS, Butler GS, Morrison CJ, King AE, Pelman GR, Overall CM (December 2002). “Utilization of a novel recombinant myoglobin fusion protein expression system to characterize the tissue inhibitor of metalloproteinase (TIMP)-4 and TIMP-2 C-terminal domain and tails by mutagenesis. The importance of acidic residues in binding the MMP-2 hemopexin C-domain”. J. Biol. Chem. 277 (50): 48696–707. doi:10.1074/jbc.M209177200. PMID 12374789.
関連文献
編集- Massova I, Kotra LP, Fridman R, Mobashery S (1998). “Matrix metalloproteinases: structures, evolution, and diversification”. FASEB J. 12 (25n26): 1075–95. doi:10.1142/S0217984998001256. PMID 9737711.
- Nagase H, Woessner JF (1999). “Matrix metalloproteinases”. J. Biol. Chem. 274 (31): 21491–4. doi:10.1074/jbc.274.31.21491. PMID 10419448.
- Goffin F, Frankenne F, Béliard A, Perrier D'Hauterive S, Pignon MR, Geenen V, Foidart JM (2002). “Human endometrial epithelial cells modulate the activation of gelatinase a by stromal cells”. Gynecol. Obstet. Invest. 53 (2): 105–11. doi:10.1159/000053003. PMID 11961384.
- Hrabec E, Naduk J, Strek M, Hrabec Z (2007). “[Type IV collagenases (MMP-2 and MMP-9) and their substrates--intracellular proteins, hormones, cytokines, chemokines and their receptors]”. Postepy Biochem. 53 (1): 37–45. PMID 17718386.