シタグリプチン
シタグリプチンリン酸塩水和物(シタグリプチンリンさんえんすいわぶつ、Sitagliptin Phosphate Hydrate)は、DPP-4 (Dipepeptidyl peptidase-4) 阻害薬に分類される経口血糖降下薬である。DPP-4はインクレチンの分解に関係する酵素であり、これを阻害することで、高血糖時のインスリン分泌を高めて血糖値を低下させるので、2型糖尿病の治療薬として利用されている。[2]GLP-1アナログ製剤であるリラグルチドと同じくインクレチン関連薬の1つであり、SU剤に代表される経口血糖降下薬に比べて低血糖のリスクが少ないとされる。上気道感染症・尿路感染症の副作用が3%に見られたが、膵疲弊の軽減の結果かHOMA-βやプロインスリン/インスリン比を改善した[3]。頻度の高い副作用としては低血糖・下痢などが知られている。
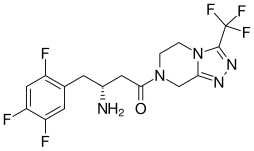 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| ライセンス | EMA:リンク、US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 | |
| 薬物動態データ | |
| 生物学的利用能 | 87% |
| 血漿タンパク結合 | 38% |
| 代謝 | 肝 (CYP3A4- and CYP2C8-mediated) |
| 半減期 | 8 to 14 h[1] |
| 排泄 | 腎 (80%)[1] |
| データベースID | |
| CAS番号 | 486460-32-6 |
| ATCコード | A10BH01 (WHO) |
| PubChem | CID: 4369359 |
| DrugBank | DB01261 |
| ChemSpider |
3571948 |
| UNII | QFP0P1DV7Z |
| ChEMBL |
CHEMBL1422 |
| 化学的データ | |
| 化学式 | C16H15F6N5O |
| 分子量 | 407.314 g/mol |
| |
承認状況
編集2007年10月、アメリカで承認された[4]後、2009年9月、欧州で承認された[5]。
2009年10月、日本国内で承認され[6]、小野薬品工業からグラクティブとして、MSD株式会社からジャヌビアとしてそれぞれ発売された。
作用機序
編集シタグリプチンはジペプチジルペプチダーゼ-4(DPP-4)の競合阻害薬である。DPP-4は食事に反応して分泌されるインクレチン、すなわちGLP-1およびGIP(消化管ホルモン(英語版))を分解し失活させる[7]。DPP-4の阻害によりGLP-1およびGIPの失活が妨げられると、それらのインスリン分泌促進効果ならびにグルカゴン分泌抑制効果が増強され、高過ぎる血糖値が正常域へ低下する。血糖値が正常域に達するとインスリンとグルカゴンに対するGLP-1およびGIPの効果は薄れるので、過剰な効果(低血糖)は他の一部の経口血糖降下薬よりは少ないとされる。
臨床的特徴
編集副作用
編集重大な副作用として、添付文書には
- アナフィラキシー反応、
- 皮膚粘膜眼症候群(Stevens-Johnson症候群)、剥脱性皮膚炎、類天疱瘡、
- 低血糖(1.0% 経口糖尿病用薬との併用時は、グリメピリド:5.3%、ピオグリタゾン:0.8%、メトホルミン:0.7%、ボグリボース:0.8%、ナテグリニド・ミチグリニド:6.5%)、
- 肝機能障害、黄疸、急性腎不全、急性膵炎、間質性肺炎、腸閉塞、横紋筋融解症、血小板減少
治験で観察された副作用は11.2%で、単剤あるいはメトホルミンまたはピオグリタゾン併用で偽薬より発現率の高かったものを列挙すると嘔気、風邪様症状、光過敏症であった[13]。低血糖の発現率は偽薬との間の有意差は認められなかった[13][14][15]。
いくつかの製造販売後調査で、DPP-4阻害薬を使用した患者の膵炎(時に致死的)について報告されており[16]、米国の添付文書には警告が記載されている[17]。日本の添付文書にも上記の如く「重大な副作用」として明記されている。しかし、DPP-4阻害薬と膵炎の因果関係は未だ完全には立証されていない[18]。2009年に発表されたラットを用いた実験では、シタグリプチンには膵炎または膵癌の発現リスクがあり、メトホルミンを併用するとリスクが減少すると結論付けられた[19]が、臨床的にはDPP-4阻害薬服用患者で膵癌が増加したとの報告はない。
重篤な関節痛を引き起こす可能性がある[20]。
出典
編集- ^ a b Herman G, Stevens C, Van Dyck K, Bergman A, Yi B, De Smet M, Snyder K, Hilliard D, Tanen M, Tanaka W, Wang A, Zeng W, Musson D, Winchell G, Davies M, Ramael S, Gottesdiener K, Wagner J (2005). “Pharmacokinetics and pharmacodynamics of sitagliptin, an inhibitor of dipeptidyl peptidase IV, in healthy subjects: results from two randomized, double-blind, placebo-controlled studies with single oral doses.”. Clin Pharmacol Ther 78 (6): 675–88. doi:10.1016/j.clpt.2005.09.002. PMID 16338283.
- ^ お薬事典2019年版 222ページ 一色高明監修より
- ^ a b “米国メルク社が、新しい経口糖尿病治療薬シタグリプチンに関する第 III 相臨床試験の成績を米国糖尿病学会にて発表” (2006年6月12日). 2014年10月31日閲覧。
- ^ "FDA Approves New Treatment for Diabetes" (Press release). U.S. Food and Drug Administration (FDA). 17 October 2006. 2006年10月17日閲覧。
- ^ “European Commission Approves ‘Januvia’ (sitagliptin) for Restricted First Line Use in Treatment of Type 2 Diabetes” (2009年9月8日). 2014年10月31日閲覧。
- ^ “万有製薬、経口2型糖尿病治療薬「ジャヌビア錠」の製造承認を取得” (2009年10月16日). 2014年10月31日閲覧。
- ^ Herman G, Bergman A, Liu F, Stevens C, Wang A, Zeng W, Chen L, Snyder K, Hilliard D, Tanen M, Tanaka W, Meehan A, Lasseter K, Dilzer S, Blum R, Wagner J (2006). “Pharmacokinetics and pharmacodynamic effects of the oral DPP-4 inhibitor sitagliptin in middle-aged obese subjects.”. J Clin Pharmacol 46 (8): 876–86. doi:10.1177/0091270006289850. PMID 16855072.
- ^ “ジャヌビア錠 インタビューフォーム”. 2016年3月31日閲覧。
- ^ Gadsby, Roger (2009). “Efficacy and Safety of Sitagliptin in the Treatment of Type 2 Diabetes” (pdf). Clinical Medicine: Therapeutics (1): 53–62.
- ^ Green JB, Bethel MA, Armstrong PW, Buse JB, Engel SS, Garg J et al. (2015). “Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes.”. N Engl J Med 373 (3): 232-42. doi:10.1056/NEJMoa1501352. PMID 26052984.
- ^ “グラクティブ錠12.5mg/25mg/50mg /100mg 添付文書” (2016年4月). 2016年7月1日閲覧。
- ^ “ジャヌビア錠12.5mg/25mg/50mg/100mg 添付文書” (2016年4月). 2016年7月1日閲覧。
- ^ a b “Januvia Side Effects & Drug Interactions”. RxList.com (2007年). 2007年11月28日閲覧。
- ^ Yazdanfar DJ (1990). “Assessing the mental status of the cognitively impaired elderly.”. J Gerontol Nurs 16 (9): 32-6. PMID 2398230.
- ^ http://www.ehealthme.com/ds/januvia/photosensitivity+reaction
- ^ Olansky L (2010). “Do incretin-based therapies cause acute pancreatitis?”. J Diabetes Sci Technol 4 (1): 228–9. doi:10.1177/193229681000400129. PMC 2825646. PMID 20167189.
- ^ “Januvia for type 2 diabetes”. Merck & Co.. 2010年7月31日閲覧。
- ^ National Prescribing Service (August 2010). “Sitagliptin for Type 2 Diabetes”. 27 August 2010閲覧。
- ^ Matveyenko AV, Dry S, Cox HI, Moshtaghian A, Gurlo T, Galasso R et al. (2009). “Beneficial endocrine but adverse exocrine effects of sitagliptin in the human islet amyloid polypeptide transgenic rat model of type 2 diabetes: interactions with metformin.”. Diabetes 58 (7): 1604-15. doi:10.2337/db09-0058. PMC 2699878. PMID 19403868.
- ^ “DPP-4 Inhibitors for Type 2 Diabetes: Drug Safety Communication - May Cause Severe Joint Pain”. FDA (2015年8月28日). 1 September 2015閲覧。
- ^ “januvia package insert” (pdf). 2016年3月31日閲覧。
外部リンク
編集- インクレチンとは MSD株式会社