クロロエチレン
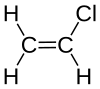
クロロエチレン(chloroethylene)は、塩素とビニル基からなる有機化合物である。化学式はCH2=CHClである。塩化ビニル(vinyl chloride)とも呼ばれる。IUPAC名はクロロエテン(chloroethene)である。
| クロロエチレン | |
|---|---|
| |
| |
別称 塩化ビニル(vinyl chloride) | |
| 識別情報 | |
| CAS登録番号 | 75-01-4 |
| KEGG | C06793 |
| 特性 | |
| 化学式 | C2H3Cl |
| モル質量 | 62.5 |
| 外観 | 無色気体 |
| 匂い | 甘ったるい臭気 |
| 密度 | 8, 気体(15℃) |
| 相対蒸気密度 | 2.2 |
| 融点 |
−154℃ |
| 沸点 |
−13℃ |
| 出典 | |
| 国際化学物質安全性カード | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
付加重合させるとポリ塩化ビニルになる。ポリ塩化ビニルを単に塩化ビニルと略称することがあるため、クロロエチレン、すなわち単量体(モノマー)の塩化ビニルであることを特に明示したい場合には塩化ビニルモノマーと呼ばれることがある。
製法
編集クロロエチレンの工業的製法には、直接塩素化法とオキシ塩素化法がある。
直接塩素化法では、まず塩化鉄(III)を触媒としてエチレンと塩素を反応させ、1,2-ジクロロエタン(エチレンジクロリド)を生成する。なお、この際に用いるエチレンはナフサの熱分解により、塩素は塩化ナトリウム(食塩)の電気分解により得られる。
その後、1,2-ジクロロエタンを500℃、15-30気圧に加熱圧縮すると分解してクロロエチレンと塩化水素が生成する。
工業的生産の場では、このとき副生成物として得られた塩化水素を空気(または酸素)と混合し、塩化銅(II)を触媒としてエチレンと反応させて更に1,2-ジクロロエタンを生成させる。これを直接塩素化法と同様に熱分解すればクロロエチレンが得られる。これをオキシ塩素化法という。
この2つの製法を併用すると、反応プロセス全体では結果的に副生成物が発生しないため、環境負荷を抑えることができるという特長を持つ。このため1950年代以降、この2つを併用した製法が広く普及した。
塩化ビニル(モノマー)の2016年度日本国内生産量は 2,588,296 t、工業消費量は 435,644 t である[1]。
歴史
編集1835年にユストゥス・フォン・リービッヒとその教え子であるアンリ・ヴィクトル・ルニョーにより発見された。この時はジクロロエタンを水酸化カリウムのエタノール溶液で処理して得られた。
安全性
編集ジクロロエタンは引火性が強く、水分の存在下で鉄を侵す。また、特定の条件下で過酸化物を生成して爆発的に重合する。このため、取り扱いには注意が必要である。
また、塩化ビニルモノマーとしてはWHOの下部機関IARCより発癌性がある(Type1)と勧告されている。これは、1974年に塩化ビニル樹脂製造に関わる労働者から肝血管肉腫(肝がんの一種)による死亡例が報告されたこと、以後の疫学調査で塩化ビニルモノマーへの曝露と肝血管肉腫との関連性が認められたこと、ラット等を用いた動物試験においても用量の増加と共に肝血管肉腫の増加が認められたことから提案された。かつて日本では、エアロゾルの噴霧助剤として使われていたが、1970年頃に使用禁止となった。しかし、これ以降もポリ塩化ビニル生産のために製造自体は継続されている。