オキサリプラチン
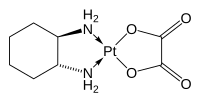
オキサリプラチン (英語: oxaliplatin、L-OHP) は、白金製剤に分類される抗がん剤である。名古屋市立大学薬学部名誉教授である喜谷喜徳らによって合成および抗癌性の発見がなされ、喜谷研究室で基礎的な研究開発が行われ、オキサリプラチンと命名された[2][3]。その後フランスのマッセイ (Mathé) らによって臨床上の開発がなされた[4]。名称にあるプラチンが白金を示している。類薬にシスプラチン、カルボプラチン、ネダプラチンがある。日本ではエルプラット (ELPLAT) の商品名でヤクルト本社が製造販売し、後発品も複数発売されている。
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Eloxatin |
| Drugs.com | monograph |
| MedlinePlus | a607035 |
| 薬物動態データ | |
| 生物学的利用能 | 完全 |
| 半減期 | ~10 - 25 分[1] |
| 排泄 | 腎臓 |
| データベースID | |
| CAS番号 |
63121-00-6 |
| ATCコード | L01XA03 (WHO) |
| PubChem | CID: 77994 |
| DrugBank |
APRD00186 |
| ChemSpider |
8062727 |
| UNII |
04ZR38536J |
| KEGG |
D01790 |
| ChEMBL |
CHEMBL414804 |
| 化学的データ | |
| 化学式 | C8H14N2O4Pt |
| 分子量 | 397.2858 g/mol |
効能・効果
編集日本で厚生労働省により認可された適応症は以下の通り[5]。臨床開発国フランスや、アメリカFDAに認可された適応症も同じである。
用法
編集レボホリナート・フルオロウラシルの持続静注投与法に、本剤を点滴投与で併用する。
このレボホリナート・フルオロウラシルの持続静注投与法というのは、抗がん剤フルオロウラシル(商品名:5-FU)の効果(細胞毒性)をレボホリナート(商品名:アイソボリン)という薬剤で増強する方法である。
アメリカなどではレボホリナートでなく、ホリナート・フルオロウラシルの持続静注投与法に併用する。日本においては、ホリナート(商品名:ロイコボリン)の「結腸・直腸癌に対するフルオロウラシル効果増強」が承認されていない。
副作用
編集特徴的な副作用は、手・足や口唇周辺部の感覚異常や知覚不全であり、殆ど全例に現れる[注釈 2]。また、他の抗がん剤と同様に骨髄抑制、食欲不振、嘔吐などの副作用もある。 オキサリプラチンの神経毒性は他の白金製剤とは異なり、急性神経毒性(投与直後から1日から2日後)と蓄積性神経毒性(総投与量 >800mg/m2以上)の2相から成る[7]:7。急性神経毒性は主にオキサリプラチンの配位子であるシュウ酸が錯体から離脱して生じると考えられる。寒冷刺激で増悪するので、冷たい物に触る、寒い場所で素手で居るなどを避けるべきである。蓄積性神経毒性は主に脊髄後根神経節などの神経細胞の変性や細胞死によると思われる。蓄積性毒性は適宜減量・休薬して回復を待つ以外に決め手となる治療法がなく、症状が進むと回復に長期間を要する(Grade3の末梢神経障害がGrade2に回復するまでの期間中央値は13週間[8])。
作用機序
編集体内で活性体に変換され、その活性体が癌細胞内のDNAとも結合する。この結合のためDNAの複製および転写が阻害される。
脚注
編集注釈
編集出典
編集- ^ Ehrsson H, Wallin I, Yachnin J (2002). “Pharmacokinetics of oxaliplatin in humans”. Med. Oncol. 19 (4): 261–265. doi:10.1385/MO:19:4:261. PMID 12512920.
- ^ Kidani, Y.; Inagaki, K.; Iigo, M.; Hoshi, A.; Kuretani K. (1978). “Antitumor activity of 1,2-diaminocyclohexaneplatinum complexes against Sarcoma-180 ascites form”. J. Med. Chem. 21: 1315–1318. doi:10.1021/jm00210a029.
- ^ Kidani, Y.; Noji, M.; Tashiro, T. (1980). “Antitumor activity of platinum(II) complexes of 1,2-diamino-cyclohexane isomers”. Gann 71: 637–643. PMID 7227714.
- ^ Mathé G, Kidani Y, Segiguchi M, Eriguchi M, Fredj G, Peytavin G, Misset JL, Brienza S, de Vassals F, Chenu E, et al. (1989). “Oxalato-platinum or 1-OHP, a third-generation platinum complex: an experimental and clinical appraisal and preliminary comparison with cis-platinum and carboplatinum”. Biomed. Pharmacother. 43: 237–250. PMID 2675999.
- ^ “エルプラット点滴静注液50mg/エルプラット点滴静注液100mg/エルプラット点滴静注液200mg 添付文書”. PMDA (2020年9月). 2021年11月28日閲覧。
- ^ 抗悪性腫瘍剤「エルプラット」、活性型葉酸製剤「レボホリナート『ヤクルト』」「小腸がん」に対する効能・効果の追加に係る承認取得 ヤクルト本社 2018年9月21日配信 2021年9月23日閲覧。
- ^ 荒川 和彦、鳥越 一宏、葛巻 直子、鈴木 勉、成田 年「抗がん剤による末梢神経障害の特徴とその作用機序」(PDF)『日本緩和医療薬学雑誌』第4巻、2011年、1-13頁。
- ^ de Gramont A, Figer A, Seymour M, Homerin M, Hmissi A, Cassidy J et al. (2000). “Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer.”. J Clin Oncol 18 (16): 2938-47. PMID 10944126.
参考文献
編集- 「エルプラット注射用100mg」添付説明書・第2版(ヤクルト本社)
- 「アイソボリン注25mg」添付説明書・第8版(ワイス)