p21
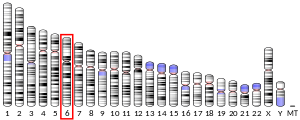
p21 / WAF1は、ヒト6番染色体 (6p21.2) に位置するCDKN1A遺伝子にコードされるタンパク質である[5][6][7]。サイクリン依存性キナーゼ阻害因子1(cyclin-dependent kinase inhibitor 1)あるいはCDK相互作用タンパク質1 (CDK-interacting protein 1) としても知られている。
機能
編集p21は強力なサイクリン依存性キナーゼ阻害因子 (CKI) である。p21 (CIP1/WAF1) タンパク質は、サイクリン-CDK2あるいはサイクリン-CDK1複合体に結合・阻害することで、G1期における細胞周期進行の調節因子として機能する。この遺伝子の発現は、がん抑制遺伝子p53によって厳密に制御されており、このタンパク質は様々なストレス刺激に応答するp53依存的細胞周期G1期停止を媒介する。これは、放射線照射などにより損傷を与えられた細胞がどのように分裂を停止するのかを明らかにした1990年代初頭における重要な発見であった。成長停止に加えて、p21は細胞老化を媒介する。興味深いことに、ヒト胚性幹細胞 (hESC) の研究では、細胞周期制御およびDNA損傷応答 (DDR) と関連したG1/Sチェックポイント経路のp53-p21軸が機能していないことが共通して示されている。重要なことに、hESCにおいてp21 mRNAは明らかに存在し、DDRの後に上昇するが、p21タンパク質は検出されない。hESCでは、p53はp21の発現を直接阻害する非常に多くのミクロRNA(例えばmiR-302a, miR-302b, miR-302c, miR-302d)を活性化している[8]。
p21(CIP1/WAF1) タンパク質は、DNAポリメラーゼ付属因子である増殖細胞核抗原 (PCNA) とも相互作用でき、S期DNA複製およびDNA損傷修復において調節的な役割を果たしている。このタンパク質はCASP3様カスパーゼによって特異的に切断され(これによりCDK2の劇的な活性化が起こる)、カスパーゼ活性化後のアポトーシスの実行に関与している可能性が示されている。しかしながら、p21はアポトーシスを阻害でき、それ自身では細胞死を誘導しない[9]。
p21(CIP1/WAF1) はサイクリンE/CDK2ならびにサイクリンD/CDK4/6複合体の活性を直接阻害するCKIである。p21はS期における細胞周期進行の制御因子として機能する[10]。p21の発現はがん抑制遺伝子p53によって制御されている。p21はp53による誘導以外でも発現することがある。この種の誘導はp21によって促進されるp53非依存的分化において大きな役割を果たしている。p21の発現は、与えられる刺激と細胞の種類の主に2つの因子に依存する。p21による成長停止は細胞の分化を促進する。ゆえに、p21は細胞増殖を妨害する。
p21タンパク質はストレス応答においても重要である[11]。p21はがん抑制遺伝子p53の転写標的である。にもかかわらず、p21の機能喪失型 (loss-of-function) 変異は(p53とは異なり)がんで多く見られることはなく、がんの発生の素因でもない。p21を欠損するよう遺伝子操作されたマウスは(p53ノックアウトマウスとは異なり)正常に発達し、野生型マウスと比べてがんに対して感受性を示さない。
臨床的重要性
編集p21は、HIVインテグラーゼと複合体を形成することによってプロウイルスと染色体との統合を失敗させ、HIV感染に対する造血細胞の抵抗性を仲介する[13]。ウイルスの複製が自然に抑制されたHIV感染者では、p21およびその関連mRNAのレベルが上昇している。p21の発現は、CD4 T細胞内でのHIVの生活環における少なくとも2つの段階、特に新たなウイルスの産生制限に影響する[14]。
イヌ転移性乳がんでは、原発腫瘍においてp21のレベルの上昇が見られ、細胞増殖が増進しているにもかかわらず転移がんでも上昇している[15][16]。
相互作用
編集脚注
編集- ^ a b c GRCh38: Ensembl release 89: ENSG00000124762 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000023067 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Entrez Gene: CDKN1A cyclin-dependent kinase inhibitor 1A (p21, Cip1)”. 2013年1月28日閲覧。
- ^ a b Harper JW, Adami GR, Wei N, Keyomarsi K, Elledge SJ (November 1993). “The p21 Cdk-interacting protein Cip1 is a potent inhibitor of G1 cyclin-dependent kinases”. Cell 75 (4): 805–16. doi:10.1016/0092-8674(93)90499-G. PMID 8242751.
- ^ el-Deiry WS, Tokino T, Velculescu VE, Levy DB, Parsons R, Trent JM, Lin D, Mercer WE, Kinzler KW, Vogelstein B (November 1993). “WAF1, a potential mediator of p53 tumor suppression”. Cell 75 (4): 817–25. doi:10.1016/0092-8674(93)90500-P. PMID 8242752.
- ^ Dolezalova D, Mraz M, Barta T, Plevova K, Vinarsky V, Holubcova Z, Jaros J, Dvorak P, Pospisilova S, Hampl A. (2012). “MicroRNAs regulate p21(Waf1/Cip1) protein expression and the DNA damage response in human embryonic stem cells.”. Stem Cells 7: 1362-72.. doi:10.1002/stem.1108.. PMID 22511267.
- ^ Almond JB, Cohen GM (April 2002). “The proteasome: a novel target for cancer chemotherapy”. Leukemia 16 (4): 433–43. doi:10.1038/sj.leu.2402417. PMID 11960320.
- ^ Gartel AL, Radhakrishnan SK (May 2005). “Lost in transcription: p21 repression, mechanisms, and consequences”. Cancer Res. 65 (10): 3980–5. doi:10.1158/0008-5472.CAN-04-3995. PMID 15899785.
- ^ Rodriguez R, Meuth M (January 2006). “Chk1 and p21 cooperate to prevent apoptosis during DNA replication fork stress”. Mol. Biol. Cell 17 (1): 402–12. doi:10.1091/mbc.E05-07-0594. PMC 1345677. PMID 16280359.
- ^ Bedelbaeva K, Snyder A, Gourevitch D, Clark L, Zhang X-M, Leferovich J, Cheverud JM, Lieberman P, Heber-Katz E (March 2010). “Lack of p21 expression links cell cycle control and appendage regeneration in mice”. PNAS, Proc. Natl. Acad. Sci. USA 107 (11): 5845–50. doi:10.1073/pnas.1000830107. PMC 2851923. PMID 20231440. 非専門家向けの内容要旨 – PhysOrg.com.
- ^ Zhang J, Scadden DT, Crumpacker CS (February 2007). “Primitive hematopoietic cells resist HIV-1 infection via p21”. J. Clin. Invest. 117 (2): 473–81. doi:10.1172/JCI28971. PMC 1783820. PMID 17273559.
- ^ Chen H, Li C, Huang J, Cung T, Seiss K, Beamon J, Carrington MF, Porter LC, Burke PS, Yang Y, Ryan BJ, Liu R, Weiss RH, Pereyra F, Cress WD, Brass AL, Rosenberg ES, Walker BD, Yu Xu G, Lichterfeld (April 2011). “CD4+ T cells from elite controllers resist HIV-1 infection by selective upregulation of p21”. Journal of Clinical Investigation 121 (4). doi:10.1172/JCI44539. 非専門家向けの内容要旨 – Harvard Gazette.
- ^ Klopfleisch R, Gruber AD (August 2009). “Differential expression of cell cycle regulators p21, p27 and p53 in metastasizing canine mammary adenocarcinomas versus normal mammary glands”. Res. Vet. Sci. 87 (1): 91–6. doi:10.1016/j.rvsc.2008.12.010. PMID 19185891.
- ^ Klopfleisch R, von Euler H, Sarli G, Pinho SS, Gärtner F, Gruber AD. (2010). “Molecular Carcinogenesis of Canine Mammary Tumors: News From an Old Disease”. Veterinary Pathology 228 (1): 91–96. doi:10.1177/0300985810390826. PMID 21149845.
- ^ Chen W, Sun Z, Wang XJ, Jiang T, Huang Z, Fang D, Zhang DD (June 2009). “Direct interaction between Nrf2 and p21(Cip1/WAF1) upregulates the Nrf2-mediated antioxidant response”. Mol. Cell. 34 (6): 663–73. doi:10.1016/j.molcel.2009.04.029. PMID 19560419.
- ^ a b Ono T, Kitaura H, Ugai H, Murata T, Yokoyama KK, Iguchi-Ariga SM, Ariga H (October 2000). “TOK-1, a novel p21Cip1-binding protein that cooperatively enhances p21-dependent inhibitory activity toward CDK2 kinase”. J. Biol. Chem. 275 (40): 31145–54. doi:10.1074/jbc.M003031200. PMID 10878006.
- ^ Mitsui K, Matsumoto A, Ohtsuka S, Ohtsubo M, Yoshimura A (October 1999). “Cloning and characterization of a novel p21(Cip1/Waf1)-interacting zinc finger protein, ciz1”. Biochem. Biophys. Res. Commun. 264 (2): 457–64. doi:10.1006/bbrc.1999.1516. PMID 10529385.
- ^ a b c Abbas T, Sivaprasad U, Terai K, Amador V, Pagano M, Dutta A (September 2008). “PCNA-dependent regulation of p21 ubiquitylation and degradation via the CRL4Cdt2 ubiquitin ligase complex”. Genes Dev. 22 (18): 2496–506. doi:10.1101/gad.1676108. PMC 2546691. PMID 18794347.
- ^ a b McKenzie PP, Danks MK, Kriwacki RW, Harris LC (July 2003). “P21Waf1/Cip1 dysfunction in neuroblastoma: a novel mechanism of attenuating G0-G1 cell cycle arrest”. Cancer Res. 63 (13): 3840–4. PMID 12839982.
- ^ Law BK, Chytil A, Dumont N, Hamilton EG, Waltner-Law ME, Aakre ME, Covington C, Moses HL (December 2002). “Rapamycin potentiates transforming growth factor beta-induced growth arrest in nontransformed, oncogene-transformed, and human cancer cells”. Mol. Cell. Biol. 22 (23): 8184–98. doi:10.1128/MCB.22.23.8184-8198.2002. PMC 134072. PMID 12417722.
- ^ Yam CH, Ng RW, Siu WY, Lau AW, Poon RY (January 1999). “Regulation of cyclin A-Cdk2 by SCF component Skp1 and F-box protein Skp2”. Mol. Cell. Biol. 19 (1): 635–45. PMC 83921. PMID 9858587.
- ^ Zhao H, Jin S, Antinore MJ, Lung FD, Fan F, Blanck P, Roller P, Fornace AJ, Zhan Q (July 2000). “The central region of Gadd45 is required for its interaction with p21/WAF1”. Exp. Cell Res. 258 (1): 92–100. doi:10.1006/excr.2000.4906. PMID 10912791.
- ^ Yang Q, Manicone A, Coursen JD, Linke SP, Nagashima M, Forgues M, Wang XW (November 2000). “Identification of a functional domain in a GADD45-mediated G2/M checkpoint”. J. Biol. Chem. 275 (47): 36892–8. doi:10.1074/jbc.M005319200. PMID 10973963.
- ^ Azam N, Vairapandi M, Zhang W, Hoffman B, Liebermann DA (January 2001). “Interaction of CR6 (GADD45gamma ) with proliferating cell nuclear antigen impedes negative growth control”. J. Biol. Chem. 276 (4): 2766–74. doi:10.1074/jbc.M005626200. PMID 11022036.
- ^ Nakayama K, Hara T, Hibi M, Hirano T, Miyajima A (August 1999). “A novel oncostatin M-inducible gene OIG37 forms a gene family with MyD118 and GADD45 and negatively regulates cell growth”. J. Biol. Chem. 274 (35): 24766–72. doi:10.1074/jbc.274.35.24766. PMID 10455148.
- ^ Rual JF, Venkatesan K, Hao T, Hirozane-Kishikawa T, Dricot A, Li N, Berriz GF, Gibbons FD, Dreze M, Ayivi-Guedehoussou N, Klitgord N, Simon C, Boxem M, Milstein S, Rosenberg J, Goldberg DS, Zhang LV, Wong SL, Franklin G, Li S, Albala JS, Lim J, Fraughton C, Llamosas E, Cevik S, Bex C, Lamesch P, Sikorski RS, Vandenhaute J, Zoghbi HY, Smolyar A, Bosak S, Sequerra R, Doucette-Stamm L, Cusick ME, Hill DE, Roth FP, Vidal M (October 2005). “Towards a proteome-scale map of the human protein-protein interaction network”. Nature 437 (7062): 1173–8. doi:10.1038/nature04209. PMID 16189514.
- ^ Frouin I, Maga G, Denegri M, Riva F, Savio M, Spadari S, Prosperi E, Scovassi AI (October 2003). “Human proliferating cell nuclear antigen, poly(ADP-ribose) polymerase-1, and p21waf1/cip1. A dynamic exchange of partners”. J. Biol. Chem. 278 (41): 39265–8. doi:10.1074/jbc.C300098200. PMID 12930846.
- ^ Watanabe H, Pan ZQ, Schreiber-Agus N, DePinho RA, Hurwitz J, Xiong Y (February 1998). “Suppression of cell transformation by the cyclin-dependent kinase inhibitor p57KIP2 requires binding to proliferating cell nuclear antigen”. Proc. Natl. Acad. Sci. U.S.A. 95 (4): 1392–7. doi:10.1073/pnas.95.4.1392. PMC 19016. PMID 9465025.
- ^ Fotedar R, Mossi R, Fitzgerald P, Rousselle T, Maga G, Brickner H, Messier H, Kasibhatla S, Hübscher U, Fotedar A (August 1996). “A conserved domain of the large subunit of replication factor C binds PCNA and acts like a dominant negative inhibitor of DNA replication in mammalian cells”. EMBO J. 15 (16): 4423–33. PMC 452166. PMID 8861969.
- ^ Jónsson ZO, Hindges R, Hübscher U (April 1998). “Regulation of DNA replication and repair proteins through interaction with the front side of proliferating cell nuclear antigen”. EMBO J. 17 (8): 2412–25. doi:10.1093/emboj/17.8.2412. PMC 1170584. PMID 9545252.
- ^ Gulbis JM, Kelman Z, Hurwitz J, O'Donnell M, Kuriyan J (October 1996). “Structure of the C-terminal region of p21(WAF1/CIP1) complexed with human PCNA”. Cell 87 (2): 297–306. doi:10.1016/S0092-8674(00)81347-1. PMID 8861913.
- ^ Touitou R, Richardson J, Bose S, Nakanishi M, Rivett J, Allday MJ (May 2001). “A degradation signal located in the C-terminus of p21WAF1/CIP1 is a binding site for the C8 alpha-subunit of the 20S proteasome”. EMBO J. 20 (10): 2367–75. doi:10.1093/emboj/20.10.2367. PMC 125454. PMID 11350925.
- ^ Yu P, Huang B, Shen M, Lau C, Chan E, Michel J, Xiong Y, Payan DG, Luo Y (January 2001). “p15(PAF), a novel PCNA associated factor with increased expression in tumor tissues”. Oncogene 20 (4): 484–9. doi:10.1038/sj.onc.1204113. PMID 11313979.
- ^ Wang Z, Bhattacharya N, Mixter PF, Wei W, Sedivy J, Magnuson NS (December 2002). “Phosphorylation of the cell cycle inhibitor p21Cip1/WAF1 by Pim-1 kinase”. Biochim. Biophys. Acta 1593 (1): 45–55. doi:10.1016/S0167-4889(02)00347-6. PMID 12431783.
- ^ Huang DY, Chang ZF (June 2001). “Interaction of human thymidine kinase 1 with p21(Waf1)”. Biochem. J. 356 (Pt 3): 829–34. doi:10.1042/0264-6021:3560829. PMC 1221910. PMID 11389691.
- ^ Oh H, Mammucari C, Nenci A, Cabodi S, Cohen SN, Dotto GP (April 2002). “Negative regulation of cell growth and differentiation by TSG101 through association with p21(Cip1/WAF1)”. Proc. Natl. Acad. Sci. U.S.A. 99 (8): 5430–5. doi:10.1073/pnas.082123999. PMC 122786. PMID 11943869.
推薦文献
編集- Marone M, Bonanno G, Rutella S, et al. (2003). “Survival and cell cycle control in early hematopoiesis: role of bcl-2, and the cyclin dependent kinase inhibitors P27 and P21.”. Leuk. Lymphoma 43 (1): 51–7. doi:10.1080/10428190210195. PMID 11908736.
- Fang JY, Lu YY (2002). “Effects of histone acetylation and DNA methylation on p21( WAF1) regulation.”. World J. Gastroenterol. 8 (3): 400–5. PMID 12046058.
- Tokumoto M, Tsuruya K, Fukuda K, et al. (2003). “Parathyroid cell growth in patients with advanced secondary hyperparathyroidism: vitamin D receptor and cyclin-dependent kinase inhibitors, p21 and p27.”. Nephrol. Dial. Transplant. 18 Suppl 3: iii9–12. PMID 12771291.
- Amini S, Khalili K, Sawaya BE (2004). “Effect of HIV-1 Vpr on cell cycle regulators.”. DNA Cell Biol. 23 (4): 249–60. doi:10.1089/104454904773819833. PMID 15142382.
- Zhang Z, Wang H, Li M, et al. (2006). “Novel MDM2 p53-independent functions identified through RNA silencing technologies.”. Ann. N. Y. Acad. Sci. 1058: 205–14. doi:10.1196/annals.1359.030. PMID 16394138.