造血
造血(ぞうけつ、英: hematopoiesis, h(a)emopoiesis[注釈 1][注釈 2])は、血液の細胞成分を形成することである。血球造血、血球新生、血球産生とも呼ばれる。すべての細胞血液成分は、造血幹細胞に由来する[2]。健康な成人では、末梢循環の定常状態レベルを維持するために、毎日約1011から1012個の新しい血液細胞が作られる[3][4][要ページ番号]。
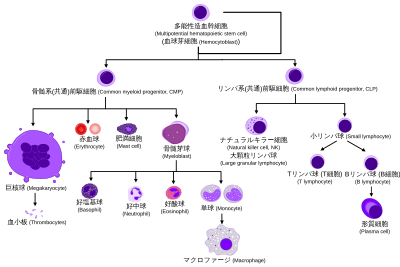
分化過程
編集造血幹細胞
編集造血幹細胞(haematopoietic stem cells、HSC)は、骨の髄質(骨髄)に存在し、さまざまな種類のすべての成熟した血液細胞や組織を生み出す独自の能力を持っている[2]。HSCは自己複製細胞であり、分化しても少なくとも娘細胞の一部がHSCとして残るため、幹細胞の蓄えが枯渇することはない。この現象を非対称分裂という[5]。HSCの他の娘細胞(骨髄系前駆細胞とリンパ系前駆細胞)は、1つまたは複数の特定種類の血球の産生につながる他の分化経路のいずれかをたどることができるが、自らを更新することはできない。前駆細胞の蓄積は不均一であり、長期自己複製HSCと、一過性自己複製HSC(短期とも呼ばれる)の2つのグループに分けられる[6]。これは、体内の主要な生命現象の一つである。
細胞型
編集すべての血液細胞は3つの系統に分けられる[7]。
- 赤血球は、酸素を運ぶ細胞である。赤血球は機能を持ち、血液中に放出される。未熟な赤血球である網赤血球の数から、赤血球造血の速度を推定することができる。
- リンパ球は、適応免疫系の礎石となる細胞である。リンパ球は、リンパ系(共通)前駆細胞に由来する。リンパ球系列は、T細胞、B細胞、ナチュラルキラー細胞で構成されている。これがリンパ造血である。
- 顆粒球、巨核球、マクロファージなどの骨髄系細胞は、骨髄系(共通)前駆細胞に由来し、自然免疫や血液凝固などの多様な役割に関与している。これが骨髄造血である。
顆粒造血(または顆粒球形成)とは、顆粒球ではあるが髄外成熟を伴う肥満細胞を除いて、顆粒球の造血である[8]。
用語法
編集1948年から1950年にかけて、「細胞および血液・造血器疾患の命名法の明確化に関する委員会」[訳語疑問点]が、血液細胞の命名法に関する報告書を発行した[9][10]。用語の概要は、発達の初期段階から最終段階まで、次のとおりである。
| 英語 | 日本語訳 (参考) |
|---|---|
| [root]blast | [語源]芽細胞 |
| pro[root]cyte | 前[語源]細胞 |
| [root]cyte | [語源]細胞 |
| meta[root]cyte | メタ[語源]細胞 |
| mature cell name | 成熟細胞名 |
赤芽球コロニー形成単位(CFU-E)の語源は「rubri」、顆粒球-単球コロニー形成単位(CFU-GM)の語源は「granulo」または「myelo」と「mono」、リンパ球コロニー形成単位(CFU-L)の語源は「lympho」、巨核球コロニー形成単位(CFU-Meg)の語源は「megakaryo」である。この命名法によれば、赤血球形成の段階は、rubriblast(ルブリブラスト)、prorubricyte(プロルブリサイト)、rubricyte(ルブリサイト)、metarubricyte(メタルブリサイト)、そしてerythrocyte(赤血球)となる。しかし、現在では次の命名法が主流となっているようである。
| 委員会\語源 | "lympho" | "rubri" | "granulo" or "myelo" | "mono" | "megakaryo" |
|---|---|---|---|---|---|
| 系統 Lineage |
リンパ球 |
骨髄 |
骨髄 |
骨髄 |
骨髄 |
| コロニー形成単位 CFU |
CFU-L | CFU-GEMM → CFU-E | CFU-GEMM → CFU-GM → CFU-G | CFU-GEMM → CFU-GM → CFU-M | CFU-GEMM → CFU-Meg |
| 形成過程 Process |
リンパ球形成 |
赤血球形成 |
顆粒球形成 |
単球形成 |
血小板形成 |
| [語源]芽細胞 [root]blast |
リンパ芽球 |
前赤芽球 |
骨髄芽球 |
単芽球 |
巨核芽球 |
| 前[語源]細胞 pro[root]cyte |
前リンパ球 |
多染性赤芽球 |
前骨髄球 |
前単球 |
前巨核球 |
| [語源]細胞 [root]cyte |
– | 正染性赤芽球 |
好酸性骨髄球/好中骨髄球/好塩基骨髄球 |
巨核球 | |
| メタ[語源]細胞 meta[root]cyte |
大リンパ球 |
網赤血球 |
好酸性/好中性/好塩基性後骨髄球, 好酸性/好中性/好塩基性桿状核球 |
初期単球[訳語疑問点] |
- |
| 成熟細胞名 mature cell name |
小リンパ球 |
赤血球 |
顆粒球 (好酸球, 好中球, 好塩基球) |
単球 |
血小板 |
破骨細胞は、単球/好中球系の造血細胞から発生し、特にCFU-GMからも発生する。
部位
編集発育中の胚では、血島と呼ばれる卵黄嚢内の血液細胞の集合体で血液が形成される。発育が進むにつれて、脾臓、肝臓、リンパ節で血液形成が行われる。骨髄が発達すると、最終的には生体全体の血液細胞の大部分を形成する役割を担う[2]。ただし、リンパ系細胞の成熟、活性化、および一部の増殖は、脾臓、胸腺、およびリンパ節で行われる。造血は、小児では大腿骨や脛骨などの長骨の骨髄で行われ、成人では主に骨盤、頭蓋骨、脊椎骨、胸骨で行われる[11]。
骨髄外
編集場合によっては、肝臓、胸腺、脾臓が、必要に応じて造血機能を再開することがある。これは「髄外造血」と呼ばれている。その結果、これらの臓器のサイズが大幅に大きくなる可能性がある。胎児発育期では、骨やそれに伴う骨髄の発達が後になるため、肝臓が主要な造血器官として機能する。そのため、胎児発育期には肝臓が肥大する[12]。髄外造血および骨髄造血は、成人期の心血管疾患や炎症に対して白血球を供給する可能性がある[13][14]。脾臓マクロファージと接着分子は、心血管疾患における髄外骨髄細胞生成の調整に関与している可能性がある[15][16]。
成熟
編集- 造血細胞の形態的特徴を、ライト染色、メイギムザ染色、メイグリュンワルドギムザ染色で見られるように示す。括弧内には特定の細胞の別称を示した。
- 特定の細胞は、複数の特徴的な外観を持つ場合がある。このような場合、同じ細胞の複数の表現が含まれている。
- 単球とリンパ球は、顆粒球形成で生成される顆粒球(好塩基球、好中球、好酸球)とは対照的に、無顆粒球を構成する。
- [1] 右側の多染性赤血球(網赤血球)は、メチレンブルーまたはアズールBで染色すると特徴的な外観を示す。
- [2] 右側の赤血球は、顕微鏡で見たときの実際の外観をより正確に表している。
- [3] 他の細胞は単球から発生する:破骨細胞、ミクログリア(中枢神経系)、ランゲルハンス細胞(表皮)、クッパー細胞(肝臓)。
- [4] Tリンパ球とBリンパ球を分割して明確化し、形質細胞がB細胞から発生することをよりよく示している。なお、B細胞とT細胞の外観は、特殊な染色をしない限り違いはないことに留意すること。
幹細胞が成熟すると、遺伝子発現が変化し、なり得る細胞型が制限されることで、特定の細胞型に近づく(細胞分化と言う)。これらの変化は、細胞表面にあるタンパク質の存在を監視することで追跡されることが多くある。逐次変化を重ねる度に、細胞は最終的な細胞型に近づき、異なる細胞型になる可能性がさらに制限される。
細胞運命決定
編集造血について決定論と確率論の2つのモデルが提案されている[17]。骨髄中の幹細胞およびその他の未分化の血液細胞については、コロニー刺激因子やその他の造血微小環境因子が細胞の分化経路を決定するという、造血の「決定論」で説明されるのが一般的である[2]。これは造血を説明する古典的な方法である。「確率論」では、未分化の血液細胞がランダム性によって特定の細胞種に分化する。この理論は、マウスの造血前駆細胞の集団内において、幹細胞因子であるSca-1の分布に潜在する確率的変化により、細胞分化の速度が変化するグループに集団が細分化されるという実験結果によって裏付けられている。たとえば、エリスロポエチン(赤血球分化因子)の影響下では、Sca-1のレベルで定義される細胞の亜集団は、残りの集団に比べて7倍高い割合で赤血球に分化した[18]。さらに、成長が許された場合は、この亜集団が元の亜集団の細胞を再構築することが示され、これが確率的で可逆的なプロセスであるという理論が支持された。確率論が重要と考えられるもう一つの観点は、アポトーシスと自己複製のプロセスである。この場合、造血微小環境は一部の細胞を生き残らせ、そして一部の細胞はアポトーシスを起こして死滅させる[訳語疑問点][2]。異なる細胞型間のバランスを調整することで、骨髄は最終的に生成される異なる細胞の量を変えることができる[19]。
成長因子
編集SCF = 幹細胞因子(en); Tpo = トロンボポエチン; IL = インターロイキン; GM-CSF = 顆粒球マクロファージ-コロニー刺激因子; Epo = エリスロポエチン; M-CSF = マクロファージ-コロニー刺激因子(en); G-CSF = 顆粒球コロニー刺激因子; SDF-1 = 間質細胞由来因子-1(en); FLT-3リガンド = FMS様チロシンキナーゼ-3リガンド(en); TNF-a = 腫瘍壊死因子-α; TGFβ = トランスフォーミング増殖因子-β[20][21]
健康なヒトでは、赤血球と白血球の産生は非常に精密に調節されており、感染症にかかると白血球の産生は急速に増加する。これらの細胞の増殖と自己複製は、成長因子に依存している。造血細胞の自己複製と発達における主要な役割を果たしている一つに、造血幹細胞(HSC)上のc-kit受容体に結合する幹細胞因子(SCF)がある[22]。SCFの欠如は致命的である。他にも、インターロイキン IL-2、IL-3、IL-6、IL-7など、増殖や成熟を制御する重要な糖タンパク質成長因子がある。また、コロニー刺激因子(CSF)と呼ばれる別の因子は、委任細胞[訳語疑問点]の産生を特異的に刺激する。CSFには、顆粒球-マクロファージCSF(GM-CSF)、顆粒球CSF(G-CSF)、マクロファージCSF(M-CSF)の3種類がある[23]。これらは、顆粒球形成を刺激し、前駆細胞または最終産物細胞のいずれにも活性化を示す。
骨髄系前駆細胞が赤血球になるためにエリスロポエチンが必要である[20]。一方、トロンボポエチンは、骨髄系前駆細胞を巨核球(血小板産生細胞)に分化させる[20]。右の図は、サイトカインとそれらが生み出す分化した血液細胞の例を示す[24]。
転写因子
編集成長因子はシグナル伝達経路を開始し、これが転写因子の活性化をもたらす。成長因子は、因子の組み合わせと細胞の分化段階に応じて異なる結果を引き起こす。たとえば、PU.1の長期間発現は骨髄系分化が進み、PU.1活性の短期的な誘導は未成熟好酸球を形成する[25]。近年、造血においてNF-κBなどの転写因子がマイクロRNA(例:miR-125b)によって調節されていることが報告された[26]。
造血幹細胞(HSC )から多能性前駆細胞(MPP)への分化の最初の主要な役割は、転写因子CCAAT/エンハンサー結合タンパク質-α(C/EBPα)である。C/EBPαの変異は、急性骨髄性白血病と関連している[27]。この時点で、細胞は赤血球-巨核球系統系に分化するか、またはリンパ系および骨髄系の系統に分化することができる。これらの系統は、リンパ球系多能性前駆体と呼ばれる共通の前駆細胞を持っている。2つの主要な転写因子があり、赤血球-巨核球系統につながるPU.1と、リンパ球系多能性前駆体につながるGATA-1である[要出典]。
他の転写因子には、Ikaros (IKZF1)[28](B細胞の発達)、Gfi1[29](Th2の発達を促進し、Th1を抑制する)、またはIRF8[30](好塩基球および肥満細胞)があげられる。重要なのは、特定の因子が、造血の異なる段階で異なる反応を誘発することである。たとえば、好中球の発達におけるCEBPαや、単球や樹状細胞の発達におけるPU.1である。プロセスが一方向性ではないことへの注意は重要で、分化した細胞は前駆細胞の属性を取り戻す可能性がある。
たとえば、PAX5因子はB細胞の発達に重要であり、リンパ腫に関連している[31]。驚くべきことに、PAX5コンディショナルノックアウトマウスでは、末梢の成熟B細胞が初期の骨髄系前駆細胞に脱分化することを可能にした。これらの発見は、転写因子が分化の開始因子としてだけでなく、分化レベルの番人として働くことを示している[32]。
転写因子の変異は、急性骨髄性白血病(AML)や急性リンパ性白血病(ALL)などの血液癌(がん)と密接に関係している。たとえば、Ikarosは多くの生物学的事象の調整因子であることが知られている。Ikarosを持たないマウスは、B細胞、ナチュラルキラー細胞、T細胞を欠いている[33]。Ikarosは、6つのジンクフィンガードメインを持ち、4つは保存されたDNA結合ドメイン、2つは二量体化のためにある[34]。非常に重要な発見は、異なるジンクフィンガーがDNAの異なる場所への結合に関与していることで、これがIkarosの多面的作用と癌への異なる関与の理由となっており、主にBCR-Abl患者に関連する変異であり、予後不良マーカーとなっている[35]。
その他の動物
編集一部の脊椎動物では、腸、脾臓、腎臓などの、結合組織の緩い間質があって、血液の供給が遅い場所であればどこでも造血が行われる[36]。
参照項目
編集- クローン性造血- 造血幹細胞(HSC)やその他の初期の血球前駆細胞が、遺伝的に異なる血液細胞の亜集団の形成に寄与する、加齢に伴う一般的な現象
- 造血薬- 骨髄を刺激して赤血球を作らせる薬剤
- 造血刺激薬:
- 顆粒球コロニー刺激因子 (G-CSF)
- 顆粒球マクロファージコロニー刺激因子 (GM-CSF)
- 白血球血管外遊出- 白血球が循環系から組織の損傷や感染の部位に向かって移動すること
脚注
編集注釈
編集- ^ [hɪˌmætoʊpɔɪˈiːsɪs, ˈhiːmətoʊ-, ˌhɛmə-][1]
- ^ ギリシア語のαἷμα(血)とποιεῖν(作る)に由来。
出典
編集- ^ “Definition of haematopoiesis | Dictionary.com” (英語). www.dictionary.com. 2021年7月13日閲覧。
- ^ a b c d e Birbrair, Alexander; Frenette, Paul S. (2016-03-01). “Niche heterogeneity in the bone marrow” (英語). Annals of the New York Academy of Sciences 1370 (1): 82–96. Bibcode: 2016NYASA1370...82B. doi:10.1111/nyas.13016. ISSN 1749-6632. PMC 4938003. PMID 27015419.
- ^ Semester 4 medical lectures at Uppsala University 2008 by Leif Jansson
- ^ Parslow TG, Stites DP, Terr AI, Imboden JB. Medical Immunology (1 ed.). ISBN 978-0-8385-6278-9
- ^ Morrison, J.; Judith Kimble (2006). “Asymmetric and symmetric stem-cell divisions in development and cancer”. Nature 441 (7097): 1068–74. Bibcode: 2006Natur.441.1068M. doi:10.1038/nature04956. hdl:2027.42/62868. PMID 16810241.
- ^ Morrison SJ, Weissman IL (Nov 1994). “The long-term repopulating subset of hematopoietic stem cells is deterministic and isolable by phenotype.”. Immunity 1 (8): 661–73. doi:10.1016/1074-7613(94)90037-x. PMID 7541305.
- ^ “Hematopoiesis from Pluripotent Stem Cells”. Antibodies Resource Library. ThermoFisher Scientific. 25 April 2020閲覧。
- ^ Mahler (2013). Haschek and Rousseaux's handbook of toxicologic pathology. associate editors, Brad Bolon and Ricardo Ochoa; illustrations editor, Beth W. (Third ed.). [S.l.]: Academic Press. p. 1863. ISBN 978-0-12-415759-0
- ^ “FIRST report of the committee for clarification of the nomenclature of cells and diseases of the blood and blood-forming organs”. American Journal of Clinical Pathology 18 (5): 443–50. (May 1948). doi:10.1093/ajcp/18.5_ts.443. PMID 18913573.
- ^ “THIRD, fourth and fifth reports of the committee for clarification of the nomenclature of cells and diseases of the blood and blood-forming organs”. American Journal of Clinical Pathology 20 (6): 562–79. (June 1950). doi:10.1093/ajcp/20.6.562. PMID 15432355.
- ^ Fernández KS, de Alarcón PA (Dec 2013). “Development of the hematopoietic system and disorders of hematopoiesis that present during infancy and early childhood.”. Pediatric Clinics of North America 60 (6): 1273–89. doi:10.1016/j.pcl.2013.08.002. PMID 24237971.
- ^ Georgiades CS, Neyman EG, Francis IR, Sneider MB, Fishman EK (Nov 2002). “Typical and atypical presentations of extramedullary hemopoiesis.”. AJR. American Journal of Roentgenology 179 (5): 1239–43. doi:10.2214/ajr.179.5.1791239. PMID 12388506.
- ^ Swirski, Filip K.; Libby, Peter; Aikawa, Elena; Alcaide, Pilar; Luscinskas, F. William; Weissleder, Ralph; Pittet, Mikael J. (2 January 2007). “Ly-6Chi monocytes dominate hypercholesterolemia-associated monocytosis and give rise to macrophages in atheromata”. Journal of Clinical Investigation 117 (1): 195–205. doi:10.1172/JCI29950. PMC 1716211. PMID 17200719.
- ^ Swirski FK, Nahrendorf M, Etzrodt M, Wildgruber M, Cortez-Retamozo V, Panizzi P, Figueiredo JL, Kohler RH, Chudnovskiy A, Waterman P, Aikawa E, Mempel TR, Libby P, Weissleder R, Pittet MJ (30 July 2009). “Identification of Splenic Reservoir Monocytes and Their Deployment to Inflammatory Sites”. Science 325 (5940): 612–616. Bibcode: 2009Sci...325..612S. doi:10.1126/science.1175202. PMC 2803111. PMID 19644120.
- ^ Dutta, P; Hoyer, FF; Grigoryeva, LS; Sager, HB; Leuschner, F; Courties, G; Borodovsky, A; Novobrantseva, T et al. (6 April 2015). “Macrophages retain hematopoietic stem cells in the spleen via VCAM-1.”. The Journal of Experimental Medicine 212 (4): 497–512. doi:10.1084/jem.20141642. PMC 4387283. PMID 25800955.
- ^ Dutta, P; Hoyer, FF; Sun, Y; Iwamoto, Y; Tricot, B; Weissleder, R; Magnani, JL; Swirski, FK et al. (September 2016). “E-Selectin Inhibition Mitigates Splenic HSC Activation and Myelopoiesis in Hypercholesterolemic Mice With Myocardial Infarction.”. Arteriosclerosis, Thrombosis, and Vascular Biology 36 (9): 1802–8. doi:10.1161/ATVBAHA.116.307519. PMC 5001901. PMID 27470513.
- ^ Kimmel, Marek (2014-01-01). “Stochasticity and determinism in models of hematopoiesis”. A Systems Biology Approach to Blood. 844. 119–152. doi:10.1007/978-1-4939-2095-2_7. ISBN 978-1-4939-2094-5. ISSN 0065-2598. PMID 25480640
- ^ Chang, Hannah H.; Hemberg, Martin; Barahona, Mauricio; Ingber, Donald E.; Huang, Sui (2008). “Transcriptome-wide noise controls lineage choice in mammalian progenitor cells”. Nature 453 (7194): 544–547. Bibcode: 2008Natur.453..544C. doi:10.1038/nature06965. PMC 5546414. PMID 18497826.
- ^ Alenzi, FQ; Alenazi, BQ; Ahmad, SY; Salem, ML; Al-Jabri, AA; Wyse, RK (Mar 2009). “The haemopoietic stem cell: between apoptosis and self renewal.”. The Yale Journal of Biology and Medicine 82 (1): 7–18. PMC 2660591. PMID 19325941.
- ^ a b c d Molecular cell biology. Lodish, Harvey F. 5. ed. : – New York : W. H. Freeman and Co., 2003, 973 s. b ill. ISBN 0-7167-4366-3
Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). “Cancers Originate in Proliferating Cells”. Molecular Cell Biology (4th ed.). New York: W. H. Freeman. Figure 24-8: Formation of differentiated blood cells from hematopoietic stem cells in the bone marrow. ISBN 0-7167-3136-3 - ^ Rod Flower; Humphrey P. Rang; Maureen M. Dale; Ritter, James M. (2007). Rang & Dale's pharmacology. Edinburgh: Churchill Livingstone. ISBN 978-0-443-06911-6
- ^ Broudy, VC (Aug 15, 1997). “Stem cell factor and hematopoiesis.”. Blood 90 (4): 1345–64. doi:10.1182/blood.V90.4.1345. PMID 9269751.
- ^ Ketley, N. J.; A. C. Newland (1997). “Haemopoietic growth factors.”. Postgrad Med J 73 (858): 215–221. doi:10.1136/pgmj.73.858.215. PMC 2431295. PMID 9156123.
- ^ Hauke, Ralph; Stefano R. Tarantolo (November 2000). “Hematopoietic Growth Factors”. Laboratory Medicine 31 (11): 613–5. doi:10.1309/HNTM-ELUV-AV9G-MA1P.
- ^ Engel, I; Murre, C (Oct 1999). “Transcription factors in hematopoiesis.”. Current Opinion in Genetics & Development 9 (5): 575–9. doi:10.1016/s0959-437x(99)00008-8. PMID 10508690.
- ^ O’Connell, R; Rao, D.; Baltimore, D (2012). “microRNA Regulation of Inflammatory Responses”. Annual Review of Immunology 30: 295–312. doi:10.1146/annurev-immunol-020711-075013. PMID 22224773.
- ^ Ho, PA; Alonzo, TA; Gerbing, RB; Pollard, J; Stirewalt, DL; Hurwitz, C; Heerema, NA; Hirsch, B et al. (Jun 25, 2009). “Prevalence and prognostic implications of CEBPA mutations in pediatric acute myeloid leukemia (AML): a report from the Children's Oncology Group.”. Blood 113 (26): 6558–66. doi:10.1182/blood-2008-10-184747. PMC 2943755. PMID 19304957.
- ^ Thompson, Elizabeth C.; Cobb, Bradley S.; Sabbattini, Pierangela; Meixlsperger, Sonja; Parelho, Vania; Liberg, David; Taylor, Benjamin; Dillon, Niall et al. (2007-03-01). “Ikaros DNA-binding proteins as integral components of B cell developmental-stage-specific regulatory circuits”. Immunity 26 (3): 335–344. doi:10.1016/j.immuni.2007.02.010. ISSN 1074-7613. PMID 17363301.
- ^ Suzuki, Junpei; Maruyama, Saho; Tamauchi, Hidekazu; Kuwahara, Makoto; Horiuchi, Mika; Mizuki, Masumi; Ochi, Mizuki; Sawasaki, Tatsuya et al. (2016-04-01). “Gfi1, a transcriptional repressor, inhibits the induction of the T helper type 1 programme in activated CD4 T cells”. Immunology 147 (4): 476–487. doi:10.1111/imm.12580. ISSN 1365-2567. PMC 4799889. PMID 26749286.
- ^ Sasaki, Haruka; Kurotaki, Daisuke; Tamura, Tomohiko (2016-04-01). “Regulation of basophil and mast cell development by transcription factors”. Allergology International 65 (2): 127–134. doi:10.1016/j.alit.2016.01.006. ISSN 1440-1592. PMID 26972050.
- ^ O'Brien, P; Morin, P, Jr; Ouellette, RJ; Robichaud, GA (Dec 15, 2011). “The Pax-5 gene: a pluripotent regulator of B-cell differentiation and cancer disease”. Cancer Research 71 (24): 7345–50. doi:10.1158/0008-5472.CAN-11-1874. PMID 22127921.
- ^ Cobaleda, C; Jochum, W; Busslinger, M (Sep 27, 2007). “Conversion of mature B cells into T cells by dedifferentiation to uncommitted progenitors”. Nature 449 (7161): 473–7. Bibcode: 2007Natur.449..473C. doi:10.1038/nature06159. PMID 17851532.
- ^ Wang, JH; Nichogiannopoulou, A; Wu, L; Sun, L; Sharpe, AH; Bigby, M; Georgopoulos, K (Dec 1996). “Selective defects in the development of the fetal and adult lymphoid system in mice with an Ikaros null mutation.”. Immunity 5 (6): 537–49. doi:10.1016/s1074-7613(00)80269-1. PMID 8986714.
- ^ Sun, L; Liu, A; Georgopoulos, K (Oct 1, 1996). “Zinc finger-mediated protein interactions modulate Ikaros activity, a molecular control of lymphocyte development.”. The EMBO Journal 15 (19): 5358–69. doi:10.1002/j.1460-2075.1996.tb00920.x. PMC 452279. PMID 8895580.
- ^ Schjerven, H; McLaughlin, J; Arenzana, TL; Frietze, S; Cheng, D; Wadsworth, SE; Lawson, GW; Bensinger, SJ et al. (Oct 2013). “Selective regulation of lymphopoiesis and leukemogenesis by individual zinc fingers of Ikaros.”. Nature Immunology 14 (10): 1073–83. doi:10.1038/ni.2707. PMC 3800053. PMID 24013668.
- ^ Zon, LI (Oct 15, 1995). “Developmental biology of hematopoiesis.”. Blood 86 (8): 2876–91. doi:10.1182/blood.V86.8.2876.2876. PMID 7579378.
推薦文献
編集- Godin, Isabelle; Cumano, Ana, eds (2006). Hematopoietic stem cell development. Springer. ISBN 978-0-306-47872-7
外部リンク
編集- 造血細胞系統 - KEGG
- 造血と骨髄組織に関するフォトアルバム
- 『造血作用』 - コトバンク
- 『赤血球の誕生-エリスロポエチンと造血の場-』(1989年) - キリンビールと三共(現・第一三共)の企画の下でヨネ・プロダクションが制作した短編映画。『科学映像館』より