発色団
発色団(はっしょくだん、chromophore)は、分子の中で色の原因となる部分である[2]。我々の目に映る色は可視光のある波長スペクトル内で吸収されない色である。発色団とは、分子内の2つの独立した分子軌道のエネルギー差が可視スペクトルの範囲内にある領域のことである。発色団にあたった可視光は、電子が基底状態から励起状態になることで吸収される。光エネルギーを捕捉したり検出したりする役割を持つ生体分子では、光があたったときに分子のコンフォメーション変化を引き起こす部分が発色団となる。


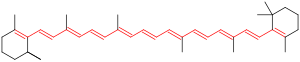
共役π結合系発色団
編集分子内の隣接する2つのp軌道がπ結合を形成するように、分子内の3つ以上の隣接するp軌道が共役π系を形成することができる。共役π系において、電子は無線アンテナがその長さに応じて光子を検出するのと同じように、p軌道の一定の距離に応じて共鳴することで所定の光子を捕捉することができる。通常、π系が多くと共役している(長い)ほど、捕捉される光子の波長は長くなる。言い換えると、分子図に見られる隣接する二重結合が加えられるたびに、黄色の光を吸収する可能性が低く、赤色の光を吸収する可能性が高くなるため、系は徐々に黄色に見える可能性が高くなると予測することができる(「共役二重結合が8個未満の共役系は、紫外線領域でのみ吸収し、人間の目には無色である」「青色または緑色の化合物は、通常、共役二重結合のみに依存しない」)[4]。
共役発色団では、多くの場合芳香族系において一連の交互の単結合と二重結合により作られた拡張π軌道であるエネルギー準位間を電子がジャンプする。一般的な例としてはレチナール(光を検出するために目で使用される)、様々な着色料、布の染料(アゾ化合物)、pH指示薬、ピコペン、βカロテン、アントシアニンなどである。スペクトルのどの波長領域の光を吸収するかは、発色団の構造のさまざまな因子により決定される。分子内の不飽和結合(多重結合)の数が多い共役系を長くしたり伸ばしたりすると、吸収が長波長側にずれる傾向がある。ウッドワード則は、共役π結合系の有機化合物の紫外-可視最大吸収波長の近似値を求めるのに使うことができる。
これらのいくつかは配位子との配位錯体に金属を含む金属錯体発色団である。例えば、植物が光合成に使用するクロロフィルや脊椎動物の血液中の酸素を輸送するヘモグロビンである。これらの2つの例では、金属はテトラピロール大員環の中心で錯化される。金属はヘモグロビンではヘム団中の鉄(ポルフィリン環の鉄)であり、クロロフィルの場合はクロリン型環で錯化されたマグネシウムである。大員環の高度に共役したπ結合系は、可視光を吸収する。中心となる金属の性質は、金属-大員環錯体の吸収スペクトルや、励起状態の存続期間などの特性にも影響を与える[5][6][7]。大員環ではなく共役π結合系を持つ有機化合物に含まれるテトラピロール部位も発色団として作用する。このような化合物の例は、黄色を呈するビリルビンやウロビリンがある。
助色団
編集助色団は、発色団に結合した原子の官能基であり、発色団が光を吸収する能力を変化させ、吸収の波長や強度を変化させるものである。
ハロクロミズム
編集ハロクロミズムは、pHの変化に伴って物質の色が変化することである。これはpH指示薬の性質であり、周囲のpHが所定の変化をすると分子構造が変化する。この構造の変化はpH指示薬の分子の発色団に影響を与える。例えば、フェノールフタレインはpHの変化に伴って次の表のように構造が変化する指示薬である。
| 構造 | ||
|---|---|---|
| pH | 0-8.2 | 8.2-12 |
| 条件 | 酸性または中性付近 | 塩基 |
| 色 | 無色 | ピンクからフクシャ |
| 色 |
pHが0-8の範囲では、分子には3つの芳香環があり、すべて中央の四面体sp3混成炭素原子に結合しているため、芳香環のπ結合は共役にならない。芳香環ではその範囲が限られているため、紫外線領域の光しか吸収せず、化合物は0-8のpH範囲では無色に見える。しかし、pHが8.2を超えると、その中心炭素が二重結合の一部になり、sp2混成になり、環内のπ結合と重なるp軌道が残る。これにより、3つの環が共役してより長い波長の可視光を吸収する拡大された発色団を形成し、フクシャ色を呈する[8]。0-12以外のpH範囲では他の分子構造変化により他の色に変化する。詳細はフェノールフタレイン参照。
一般的な発色団の吸収波長
編集| 官能基または化合物 | 吸収波長 |
|---|---|
| ブロモフェノールブルー (黄色型) | 591 nm [9] |
関連項目
編集出典
編集- ^ Kräutler, Bernhard (26 February 2016). “Breakdown of Chlorophyll in Higher Plants—Phyllobilins as Abundant, Yet Hardly Visible Signs of Ripening, Senescence, and Cell Death”. Angew. Chem. Int. Ed. 4882 (55): 4882–4907. doi:10.1002/anie.201508928. PMC 4950323. PMID 26919572.
- ^ IUPAC Gold Book Chromophore
- ^ Virtanen, Olli; Constantinidou, Emanuella; Tyystjärvi, Esa (2020). “Chlorophyll does not reflect green light – how to correct a misconception”. Journal of Biological Education: 1–8. doi:10.1080/00219266.2020.1858930.
- ^ Lipton, Mark (Jan 31, 2017). “Chapter 1. Electronic Structure and Chemical Bonding”. Purdue: Chem 26505: Organic Chemistry I (Lipton) (LibreTexts ed.). Purdue University
- ^ Gouterman, M. (1978) Optical spectra and electronic structure of porphyrins and related rings. In Dolphin, D. (ed.) The porphyrins. Academic Press, New York. Volume III, Part A, pp 1-165
- ^ Scheer, H. (2006) An overview of chlorophylls and bacteriochlorophylls: biochemistry, biophysics, functions and applications. Advances in Photosynthesis and Respiration, vol 25, pp 1-26
- ^ Shapley, P. (2012) Absorbing light with organic molecules. http://butane.chem.uiuc.edu/pshapley/GenChem2/B2/1.html
- ^ UV-Visible Absorption Spectra
- ^ Harris, C. Daniel (2016). Quantitative chemical analysis (9 ed.). New York: Freeman. p. 437. ISBN 9781464135385
外部リンク
編集- Causes of Color: physical mechanisms by which color is generated.
- High Speed Nano-Sized Electronics May be Possible with Chromophores - Azonano.com