塩化ハフニウム(IV)
塩化ハフニウム(IV)(えんかハフニウム、Hafnium(IV) chlorideまたはHafnium tetrachloride)は化学式HfCl4であらわされる無機化合物である。無色の固体であり、大部分の有機ハフニウム化合物を合成するための前駆体として用いられる。ルイス酸として働き、特定のアルキル化反応や異性化反応の触媒としても利用される。
| 塩化ハフニウム(IV) | |
|---|---|
| |
Hafnium(IV) chloride | |
| 識別情報 | |
| CAS登録番号 | 13499-05-3 |
| ChemSpider | 34591 |
| |
| |
| 特性 | |
| 化学式 | HfCl4 |
| モル質量 | 320.30 g/mol |
| 外観 | 白色結晶 |
| 融点 |
432 ℃ |
| 水への溶解度 | 分解 |
| 蒸気圧 | 1 mmHg at 190 ℃ |
| 構造 | |
| 結晶構造 | 単斜晶 |
| 配位構造 | 正四面体構造 |
| 危険性 | |
| 安全データシート(外部リンク) | MSDS |
| 主な危険性 | 刺激性、腐食性 |
| 引火点 | 不燃性 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
合成
編集塩化ハフニウム(IV)はいくつかの方法によって合成される。
- 四塩化炭素と酸化ハフニウム(IV)を450 ℃以上の温度で反応させる[1]
- 酸化ハフニウム(IV)と炭素の混合物を600 ℃以上の温度で塩素化反応させる[2]
- 炭化ハフニウム(IV)(en:Hafnium(IV) carbide)を250 ℃以上の温度で塩素化反応させる[3]
たとえば2の方法では、下記反応式で示すように、酸化ハフニウム(IV)と炭素の混合物を塩素もしくは一塩化硫黄の気流下で加熱し、反応させることによって合成される[4]。
また、水酸化ハフニウム(IV)を塩酸に溶解させ、結晶が生成するまで煮沸することによっても合成することができる。
ハフニウムとジルコニウムの化学的、物理的性質は非常に類似しており、同一の鉱石から分離されるため、ハフニウム化合物の金属中心にはジルコニウムがわずかに混在している。たとえば、ジルコンには0.05-2 %、シルト石には5.5-17 %、バッデレイ石(en:Baddeleyite)には1.0-1.8 %の酸化ハフニウム(IV)HfO2がそれぞれ含まれている[5]。そのため、塩化ハフニウム(IV)中には若干の塩化ジルコニウム(IV)が含まれており、純粋な塩化ハフニウム(IV)を得るためには精製しなければならない。
精製
編集ハフニウム、ジルコニウムともに同じ数のd軌道の電子を持ち、原子半径もわずかな違い(Hf:156.4 pm、Zr:160 pm)でしかなく[6]、それに起因する反応性の類似や化合物の物性の類似により、ハフニウム化合物の精製は困難である傾向がある。
しかしながら、四塩化物においてはジルコニウムとハフニウムの還元性の違いに基いて分離することが可能である[7]。すなわち、塩化ジルコニウム(IV)を還元させると塩素数の少ない塩化ジルコニウム(III)から金属ジルコニウムまで選択的に還元され、塩化ハフニウム(IV)は大体において還元されない。また、塩化ハフニウム(IV)は揮発性であり、塩化ジルコニウム(III)は不揮発性であるため、これらの性質を利用して簡単に分離することができる。
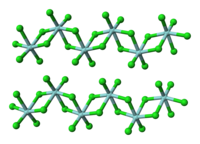
構造
編集固体の塩化ハフニウム(IV)はハフニウムの金属中心が塩素の配位子によって架橋され重合体となっていることが、塩化ジルコニウム(IV)での発見によって判明した。また、気体では塩化ハフニウム(IV)および塩化ジルコニウム(IV)は正四面体構造の単量体となっていることが、塩化チタン(IV)での発見によって判明した[8]。また、気体の塩化ハフニウム(IV)のエレクトログラフィー調査によって、Hf-Clの核間距離が2.33 Å、Cl…Clの核間距離が3.80 Åであることが明らかとなった。核間距離の比率(Hf-Cl)/(Cl…Cl)は1.630であり、これは通常の正四面体モデルの値1.633によく一致している[9]。
反応
編集塩化ハフニウム(IV)は水と激しく反応して塩化水素を発生させる。劣化したサンプルはしばしオキシ塩化物によって汚染されるが、オキシ塩化ハフニウム(IV)も塩化ハフニウム(IV)と同様に無色の固体である。テトラヒドロフラン錯体は有機溶媒に可溶な単量体であり、反応は容易に進行する[10]。
塩化ハフニウム(III)錯体は、塩化ハフニウム(IV)が非常に還元されにくいためあまり知られていないが、ナトリウムカリウム合金で還元させることによって得られる[11]。
Hf2Cl6[P(C2H5)3]4は深緑色の結晶で反磁性である。
また、塩化ハフニウム(IV)はグリニャール試薬によって配位子の塩素を置換することができる[12]。
用途
編集塩化ハフニウム(IV)は、アルケン(特にプロピレン)の重合に高活性な触媒を合成する前駆体として用いられる[13]。典型的な触媒はテトラベンジルハフニウムから誘導される。塩化マグネシウムの構造体に塩化ハフニウム(IV)とアルミニウムエトキシドもしくはジメチルチタノセンを配合したものは、ポリプロピレンの生産性が特に高いことが報告されている[14]。
また、効果的なルイス酸として様々な有機合成に用いられる。たとえば、フェロセンのアリルジメチルクロロシランによるアルキル化反応において、塩化ハフニウム(IV)は塩化アルミニウムより効果的に反応を進行させることができる。これは、ハフニウムの原子半径が大きいためフェロセン錯体に塩化ハフニウム(IV)が錯化する傾向が減少されるためである[15]。
また、1,3-双極子付加環化反応の際に、芳香族および脂肪族アルドオキシムと共に塩化ハフニウム(IV)を用いることで他のルイス酸よりも良い収率が得られ、特定のエキソ異性体を与えることが発見された[16]。
材料科学
編集塩化ハフニウムは酸化ハフニウム(IV)およびケイ酸ハフニウム(IV)を化学蒸着させる際のもっとも基本的な前駆体であり、高密度集積回路の製造に使われる高誘電率ゲート絶縁膜として用いられる。
出典
編集- ^ Encyclopedia of Chemical Technology. Kirk-Othermer. Vol.11, 4th Ed. (1991)
- ^ Hala, J. Halides, Oxyhalides and Salts of Halogen Complexes of Titanium, Zirconium, Hafnium, Vanadium, Niobium and Tantalum. Vol. 40, 176-177, (1970).
- ^ S.V. Elinson, K.I. Petrov. Analytical Chemistry of the Elements: Zirconium and Hafnium. 11, (1969).
- ^ B.S Hopkins. Chapters in the chemistry of less familiar elements, Chapter 13 Hafnium; pp 7
- ^ Ivan Edgar Newnham. Purification of Hafnium Tetrachloride. U.S. patent 2,961,293 November 22, 1960.
- ^ V. P. Spiridonov, P. A. Akishin and V. I. Tsirel’nikov, M. V. Lomonosov. Electronographic Investigation of the structure of Zirconium and Hafnium Tetrachloride Molecules in Gas Phase. Journal of Structural Chemistry [Online] Vol. 3, 1962, pp 329-330
- ^ Ivan Edgar Newnham. Purification of Hafnium Tetrachloride. U.S. patent 2,961,293 November 22, 1960.
- ^ Greenwood, N. N., Earnshaw, A. Chemistry of the Elements Second Ed. Butterworth-Heinemann, Boston, (1997).
- ^ V. P. Spiridonov, P. A. Akishin and V. I. Tsirel’nikov, M. V. Lomonosov. Electronographic Investigation of the structure of Zirconium and Hafnium Tetrachloride Molecules in Gas Phase. Journal of Structural Chemistry [Online] Vol. 3, 1962, pp 329-330.
- ^ Manxzer, L. E.; Deaton, Joe; Sharp, Paul; Schrock, R. R. (1982). “Tetrahydrofuran Complexes of Selected Early Transition Metals”. Inorg. Synth. 21: 135. doi:10.1002/9780470132524.ch31.
- ^ M. E. Riehl, S. R. Wilson, and G. S. Girolami (1993). “Synthesis, X-ray Crystal Structure, and Phosphine-Exchange Reactions of the Hafnium(III)-Hafnium(II1) Dimer Hf2Cl6[P(C2H5)3]4”. Inorg. Chem. 32: 218–222. doi:10.1021/ic00054a017.
- ^ Ian Westmoreland. Alkylation of hafnium tetrachloride with benzyl Grignard; Hafnium tetrabenzyl ; Group 4 tetrabenzyl, pp 211, 2003
- ^ Ron Dagani (2003年4月7日). “Combinatorial Materials: Finding Catalysts Faster”. Chemical and Engineering News. pp. 10
- ^ Francesco Masi, Francesco Menconi, Stefano Malquori, Renzo Invernizzi. Supported Hafnium Catalysts for Sterospecific polymerization of α-olefins, Dipartimento di Chimica e Chimica Industriale, Universita di Pisa, Pisa, Italy, 1989
- ^ S. Ahn, Y. Song, B. Yoo, I. Jung (2000). “Lewis Acid-Catalyzed Friedel-Crafts Alkylation of Ferrocene with Allylchlorosilanes”. Organometallics 19: 2777–2780. doi:10.1021/om0000865.
- ^ P. Dunn, A. Graham, R. Grigg, P. Higginson (2000). “Tandem 1,3-azaprotiocyclotransfer–cycloaddition reactions between aldoximes and divinyl ketone. Remarkable rate enhancement and control of cycloaddition regiochemistry by hafnium(iv) chloride”. Chem. Commun.: 2035–2036. doi:10.1039/b005389i.
参考文献
編集- Duraj, S. A.; Towns; Baker; Schupp, J. (1990). “Structure of cis-Tetrachlorobis(tetrahydrofuran)hafnium(IV)”. Acta Crystallographica C46: 890–2. doi:10.1107/S010827018901382X.