ライディッヒ細胞腫
ライディッヒ細胞腫(ライディッヒさいぼうしゅ、英語: Leydig cell tumor)は、(精巣)間質性細胞腫((testicular) interstitial cell tumour)とも呼ばれ、卵巣がんおよび精巣がんの性索間質性腫瘍群の一つである[1]。ライディッヒ細胞から発生する。この腫瘍はどの年齢でも発生する可能性があるが、若年成人に最も多く発生する。
| ライディッヒ細胞腫 | |
|---|---|
| 別称 | 精巣間質細胞腫 |
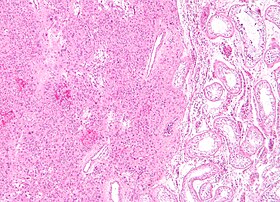 | |
| ライディッヒ細胞腫の低倍率顕微鏡写真(H&E染色) | |
| 概要 | |
| 分類および外部参照情報 | |
セルトリ・ライディッヒ細胞腫は、ライディッヒ細胞腫と、セルトリ細胞から発生するセルトリ細胞腫が混在しているものである。
概要
編集ライディッヒ細胞腫瘍の大部分は男性に見られ、通常、5~10歳または成人中期(30~60歳)に発症する。小児は典型的には思春期早発症を呈する[要出典]。
腫瘍から分泌される過剰なテストステロンのために、女性患者の1⁄3は、進行性の男性化の病相を呈する。男性化に先立って、無排卵、過少月経、無月経、脱女性化が生じる。さらに、面皰や多毛、声の低音化、陰核肥大、側頭部の毛の後退、筋骨格の増加などの兆候が見られる。血清テストステロン値は高い[要出典]。
男性では、精巣の腫脹が最も一般的な症状である。その他の症状は、年齢および腫瘍の種類によって異なる。アンドロゲンを分泌している場合、腫瘍は通常無症状であるが、思春期前の少年に思春期早発症を引き起こす事がある。腫瘍がエストロゲンを分泌している場合は、若い男子に女性化を引き起こす可能性がある。成人では、女性化により、女性化乳房、勃起不全、不妊症、女性的な毛髪分布、性腺性器の萎縮、性欲減退などの多くの問題が生じる[2]。
成因
編集動物実験では、PFOA(C8HF15O2、ペルフルオロオクタン酸)との関連性が示唆されている[3]。
診断
編集卵巣腫瘍とホルモン障害の共存は、ライディッヒ細胞腫、顆粒膜細胞腫、または肉腫を示唆している。しかし、ライディッヒ腫瘍では、ホルモン障害は2⁄3の症例でしか認められない。精巣のライディッヒ細胞腫は超音波で検出する事ができ、陰嚢の腫瘤を触知した場合には超音波検査が指示される場合があるが、これらの病変を偶然に発見する事も可能である[4]。
確定診断は、手術中または手術後の病理報告中の組織学的所見に基づく。ラインケ結晶[5]はこれらの腫瘍に典型的に見られ、診断を確定するのに役立つとされるが、ライディッヒ細胞腫の半分以下にしか見られない。ライディッヒ細胞腫の免疫組織化学的マーカーには、インヒビンα、カルレチニン、メランAが含まれる[6]。
治療
編集このタイプの腫瘍では通常の化学療法の効果は限られているが、イマチニブが有望視されている[7]。放射線治療は現在の処、出番がない[8]。
通常の治療は手術である。女性の場合、通常は妊孕性を温存する目的で片側卵管卵巣切除術が行われる。
悪性腫瘍の場合、手術は根治的なものとなり、通常は術後に補助化学療法、時には放射線療法が実施される。どのような場合でも、初期治療の後には経過観察が行われる。多くの場合、ライディッヒ細胞腫は腫瘍マーカーを上昇させないので[9]、経過観察では身体検査と画像診断を繰り返して実施する。
男性の場合、一般的には根治的な鼠径部睾丸切除術が行われる。しかし、小児や若年成人の妊孕性を維持する為に、精巣を温存する手術を行う事もある。この方法では、腫瘍が触知できない場合には、鼠径部または陰嚢部を切開し、超音波ガイドを使用する。これが可能なのは、腫瘍が一般的に単発性で、前癌病変を伴わず、再発の可能性が低い為である[10]。
腫瘍はゆっくりと成長する傾向があり、通常は良性であるため、予後は一般的に良好であるが、10%は悪性である[2][11]。組織学的に未分化な悪性腫瘍の場合、予後は不良である[9]。
その他の画像
編集出典
編集- ^ “Sertoli-Leydig cell tumor: a rare ovarian neoplasm. Case report and review of literature”. Gynecol. Endocrinol. 24 (4): 230–4. (April 2008). doi:10.1080/09513590801953465. PMID 18382911.
- ^ a b Leydig Cell Tumors: Practice Essentials, Background, Pathophysiology. (2016-10-27).
- ^ Biegel, L. B.; Liu, R. C.; Hurtt, M. E.; Cook, J. C. (1995). “Effects of ammonium perfluorooctanoate on Leydig cell function: in vitro, in vivo, and ex vivo studies”. Toxicology and Applied Pharmacology 134 (1): 18–25. doi:10.1006/taap.1995.1164. PMID 7676454.
- ^ Reddan, Tristan; Powell, Jennifer; Long, Gillian (2017). “Ultrasound of a prepubertal Leydig cell tumour of the testis”. Sonography 4 (3): 125–128. doi:10.1002/sono.12111.
- ^ “顕微鏡写真2010年度 | 医学生物学電子顕微鏡技術学会”. emtech.jp. 2021年9月19日閲覧。
- ^ “Leydig cell tumors of the testis with unusual features: adipose differentiation, calcification with ossification, and spindle-shaped tumor cells”. Am. J. Surg. Pathol. 26 (11): 1424–33. (November 2002). doi:10.1097/00000478-200211000-00004. PMID 12409718.
- ^ Basciani, Sabrina; Brama, Marina; Mariani, Stefania; De Luca, Gabriele; Arizzi, Mario; Vesci, Loredana; Pisano, Claudio; Dolci, Susanna et al. (2005-03-01). “Imatinib Mesylate Inhibits Leydig Cell Tumor Growth: Evidence for In vitro and In vivo Activity”. Cancer Research 65 (5): 1897–1903. doi:10.1158/0008-5472.can-04-2181. PMID 15753388.
- ^ Leydig Cell Tumors Treatment & Management: Medical Care, Surgical Care. (2016-10-27).
- ^ a b “Use of novel serum markers in clinical follow-up of Sertoli-Leydig cell tumours”. Clin. Chem. Lab. Med. 45 (5): 657–61. (2007). doi:10.1515/CCLM.2007.120. PMID 17484630.
- ^ “Testicular-sparing surgery for bilateral or monorchide testicular tumours: a multicenter study of long-term oncological and functional results.”. BJU Int 114 (6): 860–4. (2014). doi:10.1111/bju.12549. PMID 24180380.
- ^ “An in-depth look at Leydig cell tumor of the testis”. Arch. Pathol. Lab. Med. 131 (2): 311–7. (February 2007). doi:10.5858/2007-131-311-AILALC. PMID 17284120.
- ^ a b Zhengshan Chen, M.D., Ph.D., Manju Aron, M.D.. “Testis & epididymis - Sex cord-stromal tumors - Leydig cell tumor”. PathologyOutlines. 2021年9月20日閲覧。 Topic Completed: 4 March 2021. Minor changes: 12 April 2021.