ヘキサカルボニルモリブデン
ヘキサカルボニルモリブデン(Molybdenum hexacarbonyl)は、化学式Mo(CO)6の無機化合物である。無色の固体で、クロム、タングステン、シーボーギウムのアナログと同様に、酸化状態0で揮発性を持つ、空気中で安定な金属誘導体として特筆すべきものである。
| ヘキサカルボニルモリブデン | |
|---|---|
|
|

| |
Hexacarbonylmolybdenum(0) | |
| 識別情報 | |
| CAS登録番号 | 13939-06-5 |
| PubChem | 98885 |
| ChemSpider | 21428397 |
| EC番号 | 237-713-3 |
| 国連/北米番号 | 3466 |
| MeSH | Hexacarbonylmolybdenum |
| ChEBI | |
| Gmelin参照 | 3798, 562210 |
| |
| 特性 | |
| 化学式 | C6MoO6 |
| モル質量 | 264 g mol−1 |
| 外観 | 白色半透明の結晶 |
| 密度 | 1.96 g cm−3 |
| 融点 |
150 °C, 423 K, 302 °F |
| 沸点 |
156 °C, 429 K, 313 °F |
| 水への溶解度 | 不溶 |
| 溶解度 | テトラヒドロフラン、ジグリム、アセトニトリルにわずかに可溶[2] |
| 構造 | |
| 結晶構造 | 直方晶系 |
| 配位構造 | 八面体形分子構造 |
| 双極子モーメント | 0 D |
| 熱化学 | |
| 標準生成熱 ΔfH |
−989.1 kJ mol−1 |
| 標準燃焼熱 ΔcH |
−2123.4 kJ mol−1 |
| 危険性 | |
| 安全データシート(外部リンク) | External MSDS |
| GHSピクトグラム | 
|
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H300, H310, H315, H319, H330, H413 |
| Pフレーズ | P261, P271, P280, P304+340+311, P405, P501 |
| NFPA 704 | |
| 関連する物質 | |
| 関連物質 | ヘキサカルボニルクロム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
構造と性質
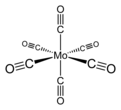
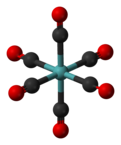
編集Mo(CO)6は、棒状の6つのCO配位子が中央のモリブデン原子から放射状に配置された八面体形分子構造を取る。「有機金属」化合物について、化学界の中で若干の意見の不一致があるが、通常、有機金属と言えば、M-C結合を介して、C-H結合を持つ有機部分と直接結合する金属原子の存在を必要とする。
多くの金属カルボニルと同様に、Mo(CO)6は、通常、一酸化炭素の雰囲気中でハロゲン化金属の還元を伴う「還元的カルボニル化」により合成される。2023年の調査では、「第6族元素のヘキサカルボニルの最も費用対効果の高い合成経路は、一酸化炭素の雰囲気中でのマグネシウム、亜鉛、アルミニウムの粉末による金属塩化物(CrCl3、MoCl5、WCl6)の還元に基づくものである」と記載された[4]。
天然での生成
編集Mo(CO)6は、最終処分場や生活排水の植物から検出されている。還元的、嫌気的な環境がMo(CO)6の生成を助長する[5]。
無機化学及び有機金属研究
編集Mo(CO)6は、学術研究において良く用いられる試薬である[6]。
1つまたはそれ以上のCO配位子が他の配位子で置き換えられる[7]。Mo(CO)6、[Mo(CO)3(MeCN)3]や関連誘導体は、アルキンメタセシス反応やポーソン・カンド反応等の有機合成の触媒として用いられる。
Mo(CO)6は、2,2'-ビピリジンと反応し、Mo(CO)4(bipy)を与える。Mo(CO)6のテトラヒドロフラン(THF)溶液の紫外線光分解で、Mo(CO)5(THF)を与える。
[Mo(CO)4(piperidine)2]
編集Mo(CO)6とピぺリジンとの熱反応により、Mo(CO)4(piperidine)2が与えられる。黄色の化合物で、2つのピぺリジン配位子は不安定であり、そのため温和な条件下で他の配位子を導入することが可能となる。例えば、沸騰ジクロロメタン中、[Mo(CO)4(piperidine)2]とトリフェニルホスフィンの反応で、cis-[Mo(CO)4(PPh3)2]が与えられる。このcis-錯体は、トルエン中でtrans-[Mo(CO)4(PPh3)2]に異性化する[8]。
[Mo(CO)3(MeCN)3]
編集Mo(CO)6は、tris(acetonitrile)誘導体に変換することもできる。この化合物は"Mo(CO)3"源としても用いることができる。例えば、塩化アリルでの処理で[MoCl(allyl)(CO)2(MeCN)2]を与え、一方、スコルピオネート配位子やシクロペンタジエニルナトリウムでの処理により、各々[MoTp(CO)3]−や[MoCp(CO)3]−を与える。これらのアニオンは、様々な求電子剤と反応する[9]。関連するMo(CO)3源には、w:cycloheptatrienemolybdenum tricarbonylがある。
Mo原子源
編集Mo(CO)6は、電子ビームにより容易に蒸発、分解してMo原子を供給するため、電子ビーム誘起蒸着に広く用いられる[10]。
安全性と取扱い
編集全ての金属カルボニルと同様、Mo(CO)6は、一酸化炭素や金属蒸気の危険な発生源となる。
出典
編集- ^ “Hexacarbonylmolybdenum (CHEBI:30508)”. Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute. 2024年5月25日閲覧。
- ^ Faller, John W.; Brummond, Kay M.; Mitasev, Branko (15 September 2006). “Hexacarbonylmolybdenum”. Encyclopedia of Reagents for Organic Synthesis. Wiley. doi:10.1002/047084289X. hdl:10261/236866. ISBN 9780470842898
- ^ Even, J.; Yakushev, A.; Dullmann, C. E.; Haba, H.; Asai, M.; Sato, T. K.; Brand, H.; Di Nitto, A. et al. (2014). “Synthesis and detection of a seaborgium carbonyl complex”. Science 345 (6203): 1491–3. Bibcode: 2014Sci...345.1491E. doi:10.1126/science.1255720. PMID 25237098. ( 要購読契約)
- ^ Bruno, Sofia M.; Valente, Anabela A.; Gonçalves, Isabel S.; Pillinger, Martyn (2023). “Group 6 Carbonyl Complexes of N,O,P-Ligands as Precursors of High-Valent Metal-Oxo Catalysts for Olefin Epoxidation”. Coordination Chemistry Reviews 478: 214983. doi:10.1016/j.ccr.2022.214983. hdl:10773/40120.
- ^ Feldmann, J. (1999). “Determination of Ni(CO)4, Fe(CO)5, Mo(CO)6, and W(CO)6 in Sewage Gas by Using Cryotrapping Gas Chromatography Inductively Coupled Plasma Mass Spectrometry”. Journal of Environmental Monitoring 1 (1): 33–37. doi:10.1039/a807277i. PMID 11529076.
- ^ Faller, J. W.; Brummond, K. M.; Mitasev, B. (2006). "Hexacarbonylmolybdenum". In Paquette, L. (ed.). Encyclopedia of Reagents for Organic Synthesis. New York: J. Wiley & Sons. doi:10.1002/047084289X.rh004.pub2. ISBN 0471936235。
- ^ “THE SYNTHESIS & SPECTROSCOPIC CHARACTERISATION OF METAL CARBONYL COMPLEXES”. www.chm.bris.ac.uk. March 9, 2008時点のオリジナルよりアーカイブ。2024年5月25日閲覧。
- ^ Darensbourg, D. J.; Kump, R. L. (1978). “A Convenient Synthesis of cis-Mo(CO)4L2 Derivatives (L = Group 5a Ligand) and a Qualitative Study of Their Thermal Reactivity toward Ligand Dissociation”. Inorg. Chem. 17 (9): 2680–2682. doi:10.1021/ic50187a062.
- ^ Elschenbroich, C.; Salzer, A. (1992). Organometallics: A Concise Introduction (2nd ed.). Weinheim: Wiley-VCH. ISBN 3-527-28165-7
- ^ Randolph, S. J.; Fowlkes, J. D.; Rack, P. D. (2006). “Focused, Nanoscale Electron-Beam-Induced Deposition and Etching”. Critical Reviews of Solid State and Materials Sciences 31 (3): 55–89. Bibcode: 2006CRSSM..31...55R. doi:10.1080/10408430600930438.
関連文献
編集- Marradi, M. (2005). “Synlett Spotlight 119: Molybdenum Hexacarbonyl [Mo(CO)6]”. Synlett 2005 (7): 1195–1196. doi:10.1055/s-2005-865206.
- Feldmann, J.; Cullen, W. R. (1997). “Occurrence of Volatile Transition Metal Compounds in Landfill Gas: Synthesis of Molybdenum and Tungsten Carbonyls in the Environment”. Environ. Sci. Technol. 31 (7): 2125–2129. Bibcode: 1997EnST...31.2125F. doi:10.1021/es960952y.
- Feldmann, J.; Grümping, R.; Hirner, A. V. (1994). “Determination of Volatile Metal and Metalloid Compounds in Gases from Domestic Waste Deposits with GC/ICP-MS”. Fresenius' J. Anal. Chem. 350 (4–5): 228–234. doi:10.1007/BF00322474.
