フィブリル
フィブリル(英: Fibril、ラテン語のfibraに由来[1]、原線維(げんせんい)とも呼ぶ)は、ほぼすべての生物に見られる構造的な生体材料である。繊維やフィラメント(タンパク質線維(英語版))と混同しないように、フィブリルは直径10~100ナノメートルの傾向がある(繊維はマイクロ~ミリメートルスケールの構造で、フィラメントは直径が約10~50ナノメートル)。フィブリルは通常、単独で見られるのではなく、生物学的システムで一般的に見られるより大きな階層構造の一部である。生物システムにはフィブリルが多く存在するため、それらの研究は微生物学、バイオメカニクス、材料科学の分野で非常に重要である。
構造と力学
編集フィブリルは直鎖状の生体高分子からなり、長さと直径の比率が高い棒状の構造が特徴である。多くの場合、フィブリルは自発的にらせん状に配置される。生物力学の問題では、フィブリルはナノメートルスケールでほぼ円形の断面積を持つ古典的な梁(はり、ビーム)として特徴づけられる。そのため、単純な梁曲げ方程式を適用して、超低荷重条件下でのフィブリルの曲げ強度を計算できる。ほとんどの生体高分子と同様に、フィブリルの応力-ひずみ関係は、線形弾性領域の手前に特徴的な爪先領域-踵領域を示す傾向がある[2]。生体高分子とは異なり、フィブリルは均質な材料のように振る舞うわけではなく、降伏強度は体積に応じて変化することが示されており、構造依存性を示している[3]。
異なる起源のフィブリル間の構造の違いは、通常、X線回折によって決定される[2]。走査型電子顕微鏡(SEM)を使用して、コラーゲンの特徴的な67 nmのバンドのような、より大きなフィブリル種の特定の詳細を観察できる。しかし多くの場合、完全な構造を決定するために十分な微細さを得られない。
水和は、フィブリル材料の機械的特性に顕著な効果をもたらすことが示されている。水の存在は、コラーゲンフィブリルの剛性を低下させるだけでなく、応力緩和率と強度を増加させることが示されている[4]。生物学的な観点からは、水分含有はフィブリル構造の強靭化機構として作用し、より高いエネルギー吸収とより大きなひずみ能力を可能にする。
原線維形成
編集原線維形成(英: fibrillogenesis)とは、結合組織のコラーゲン線維に多く見られる微細なフィブリルの伸長である。原線維形成の明確なメカニズムは未だに不明であるものの、基礎研究から得られた多くの仮説により、多くの可能性のあるメカニズムが発見されている。初期の実験では、組織からI型コラーゲンを蒸留し、溶液を制御してフィブリルに再結合させることができた。後の研究では、コラーゲンモノマー上の結合部位の組成と構造を理解するのに役立っている。コラーゲンは、コラーゲンの自己組織化をサポートする可溶性前駆体であるプロコラーゲンとして合成される。コラーゲンフィブリルは生体内で50個近くの結合成分を有するため、生体内で原線維形成を起こすための明確な要件は依然として不可解である[5]。
酸性溶液や生理食塩水を用いてコラーゲンを組織から抽出し、温度やpHを変化させることでフィブリルに再配列させることができる[6]。実験により、コラーゲンモノマー間の引力が再配列を助けることが発見された[7]。コラーゲンは合成反応の前駆体であるプロコラーゲンの役割を果たしており、コラーゲンの自己重合が確認されている。
自然界のプロセス
編集自然界には30種類以上のコラーゲンが存在し、化学組成は似ているものの結晶構造が異なる。圧倒的にI型コラーゲンとII型が豊富である。それらは実験室(in vitro)で自発的にフィブリルを形成するが、フィブロネクチン、フィブロネクチン結合、コラーゲン結合インテグリン、およびコラーゲンVは、I型コラーゲン形成に不可欠であり、XI型コラーゲンはII型コラーゲン形成に不可欠である。したがって、細胞機構は、タンパク質の自己組織化プロセスにおいて重要な役割を果たしている。
動物の場合
編集コラーゲン
編集コラーゲンは、動物の多くの結合組織の細胞外にある主要な構造タンパク質である[8]。結合組織の主成分として、哺乳類のタンパク質の中では最も量が多く、体内の全タンパク質量の25~35%を占めている。
コラーゲンのフィブリルは波状構造(クリンプ構造)である。腱などのコラーゲンの応力-ひずみ曲線は、いくつかの領域に細分化される。小さなひずみの領域である「爪先(つまさき)」領域は、光学顕微鏡で見ることができるコラーゲンフィブリルの中で、巨視的な波状構造の移動に対応する。より大きなひずみの「踵(かかと)」および「線形」領域では、それ以上の構造変化は見られない。
トロポコラーゲンは分子成分繊維であり、3本の左巻きポリペプチド鎖が互いに巻き付いて(図を参照)、右巻きの三重らせんを形成している。
筋肉は、アクチン線維と相互作用するミオシンの制御可能な摺動/把持を介して収縮および伸展する。アクチンは2つのポリペプチドがらせん状に結合して構成されており、ミオシンはクロスブリッジという小さなハート型の構造を持っている。クロスブリッジがアクチンフィラメントに結合したり、結合を解除することで、これらのコラーゲンの相対的な動きを助け、それゆえに筋肉全体の動きを助けている。
エラスチンは、皮膚、血管、肺組織などのさまざまな軟組織に共通する繊維状タンパク質である。各モノマーは互いに連結して三次元ネットワークを形成し、変形するまでに200%以上のひずみに耐えることができる[9]。
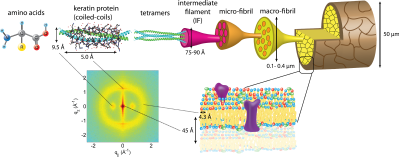
ケラチンは、主に毛髪、爪、ひづめ、角、羽軸(鳥の羽の軸)などに含まれる構造タンパク質である[10]。基本的にケラチンはポリペプチド鎖によって形成され、硫黄架橋でαヘリックスに巻きついたり、水素結合によって結合されたβシートに結合する。αケラチンよりも強靭なβケラチンは、鳥類や爬虫類に多く見られる。
レジリンとスパイダーシルク
編集レジリンは、エラストマー性の昆虫タンパク質で、αヘリックスとβシート構造の両方から構成される[11]。これは自然界で最も弾力性のあるタンパク質の一つで、剛性は0.6MPaと低く、エネルギー回復率は98%と高く、飛んでいる昆虫の羽ばたきやノミのジャンプの効率化に役立っている。
スパイダーシルク(クモの糸)フィブリルは、強度を担う硬い結晶化したβシート構造と周囲の非晶質マトリックスで構成されており、靭性と伸長能力を向上させている[12]。他の天然フィブリルと比べて、非常に高い引っ張り強度と延性を持ち、密度は低い。その特徴は、役目やクモの種類によって異なる。
植物の場合
編集一次細胞壁は顕著な引っ張り強度を持ち、それはセルロース分子または水素結合によって安定化したグルコース残基の長鎖から引き出されている[13]。セルロース鎖は重なり合って平行に配列していることが観察され、類似する極性によりセルロースミクロフィブリルを形成する。植物においては、これらのセルロースミクロフィブリルは層状(正式にはラメラとして知られる)に配置され、表面の長い架橋糖鎖分子によって細胞壁内で安定化している。糖鎖分子は、植物由来のセルロースがそれ自身を構成できる潜在的なネットワークの複雑さを増大させる。一次細胞壁で、セルロースミクロフィブリルと、相補的な糖鎖ネットワークの両方に隣接しているペクチンは、負に帯電したガラクツロン酸単位を多く含む多糖類である。さらに、セルロースミクロフィブリルは、制御された細胞増殖を介して植物の形状にも寄与している。細胞壁内のミクロフィブリルの立体的な配置は、最終的に細胞の成長と増殖につながる膨圧システムを形成する。セルロースミクロフィブリルは、細胞膜の細胞外表面にあるセルロース合成酵素によって組み立てられるという点で、独特なマトリックス高分子である。植物は、セルロースミクロフィブリルが微小管の皮質配列の上に配置される機構により、「ミクロフィブリルの配向を制御することで、その将来の形態を予測することができる」と考えられている。
アミロース
編集アミロースの所定サンプルを撹拌すると、フィブリル状の結晶が形成され母液から析出されるとされている。これらの長いフィブリルは、電子顕微鏡を使用して画像化することができ、シシカバブに似た横条線を明らかにできる[要出典]。アミロースフィブリルは、小さな棒状のフィブリルとラス状(薄い小幅板状)の結晶を持つものの、2つの形態のいずれかに分類される。
木材
編集木材のフィブリル構造は、木材の機械的安定性と、ミネラルや水の輸送路を持つ能力の両方で、重要な役割を果たしていると言われている。特にトウヒ材(オウシュウトウヒ)などは、規格化径2.5 nmのセルロースフィブリルを持っていると報告されている。また、材齢とフィブリルの長手方向に対するねじれ角の関連性も報告されている。早材は安息角が4.6±0.6°と一貫しているのに対し、晩材は4.6°から19.8±0.7°までの遷移領域を持つと言われている[14]。晩材では、セルロースフィブリルの2つのらせん角領域は連続しておらず、つまり「古い」樹木には異なる機械的要件を満たす2つの独立した仮道管構造が存在することを意味している。さらに、長手方向に配向したフィブリルは引っ張り強度を向上させるが、一方、晩材の仮道管に特有の20°傾斜したフィブリルが加わると、圧縮に対する安定性が得られる。
セルフクリーニング特性
編集ヤモリの足指パッドの強力な粘着力、容易な剥離性、およびセルフクリーニング性を模倣するために、フィブリルをベースとした接着剤を作成することができる。これらの重要機能は、剛毛と呼ばれる100万個のミクロフィブリルからなる基本的な構造と、さらにスパチュラと呼ばれる数十億個のナノサイズの枝から構成される階層構造に由来している。
この現象を模倣するには、4つの異なる設計ステップが必要である[15]。
- 垂直に整列したマイクロ/ナノフィブリルアレイの作成
- さまざまな先端形状の作成
- 異方性ジオメトリを含む
- 階層構造を構築。
成熟した骨基質
編集成熟した骨基質(こつきしつ、bone matrix)を模倣するために、自己組織化フィブリルを使用して、所与のミネラル基質を整列させることができる。これは、疎水性アルキル尾部と親水性オリゴペプチド頭部を持つ自己組織化分子を使用して実現される。これらの分子は、その場でミセル構造を形成し、低pHでジスルフィド架橋を形成し、200 kDaの高分子ナノフィブリルの形成と結晶化をもたらす[要出典]。ミネラル基質は、最終的にホスホセリン残基を介して合成フィブリルと相互作用し、ミネラルの核生成と成長をもたらす。
参照項目
編集脚注
編集- ^ “Online Etymology Dictionary” (英語). www.etymonline.com. 2017年3月31日閲覧。
- ^ a b Fratzl, Peter (1998). “Fibrillar Structure and Mechanical Properties of Collagen” (英語). Journal of Structural Biology 122 (1–2): 119–122. doi:10.1006/jsbi.1998.3966. PMID 9724612.
- ^ Shen, Zhilei L.; Dodge, Mohammad Reza; Kahn, Harold; Ballarini, Roberto; Eppell, Steven J. (2008-10-15). “Stress-Strain Experiments on Individual Collagen Fibrils”. Biophysical Journal 95 (8): 3956–3963. Bibcode: 2008BpJ....95.3956S. doi:10.1529/biophysj.107.124602. ISSN 0006-3495. PMC 2553131. PMID 18641067.
- ^ Chimich, D. (1992). “Water content alters viscoelastic behaviour of the normal adolescent rabbit medial collateral ligament” (英語). Journal of Biomechanics 25 (8): 831–837. doi:10.1016/0021-9290(92)90223-N. PMID 1639827.
- ^ Kadler, Karl E; Hill, Adele; Canty-Laird, Elizabeth G (2017-05-02). “Collagen fibrillogenesis: fibronectin, integrins, and minor collagens as organizers and nucleators”. Current Opinion in Cell Biology 20 (5–24): 495–501. doi:10.1016/j.ceb.2008.06.008. ISSN 0955-0674. PMC 2577133. PMID 18640274.
- ^ Gross, J.; Kirk, D. (1958-08-01). “The heat precipitation of collagen from neutral salt solutions: some rate-regulating factors”. The Journal of Biological Chemistry 233 (2): 355–360. ISSN 0021-9258. PMID 13563501.
- ^ Prockop, D. J.; Fertala, A. (1998-06-19). “Inhibition of the self-assembly of collagen I into fibrils with synthetic peptides. Demonstration that assembly is driven by specific binding sites on the monomers”. The Journal of Biological Chemistry 273 (25): 15598–15604. doi:10.1074/jbc.273.25.15598. ISSN 0021-9258. PMID 9624151.
- ^ Kadler, Karl E; Hill, Adele; Canty-Laird, Elizabeth G (2017-03-31). “Collagen fibrillogenesis: fibronectin, integrins, and minor collagens as organizers and nucleators”. Current Opinion in Cell Biology 20 (5–24): 495–501. doi:10.1016/j.ceb.2008.06.008. ISSN 0955-0674. PMC 2577133. PMID 18640274.
- ^ Gosilin, J.M.; Aaron, B.B (1981). “Elastin as a Random-network elastomer, a mechanical and optical analysis of single elastin fibers”. Biopolymers 20 (6): 1247–1260. doi:10.1002/bip.1981.360200611.
- ^ Meyers, M. A. (2014). Biology in Materials Science. Cambridge, UK: Cambridge University Press
- ^ Weis-Fough, T (1961). “Molecular interpretation of the elasticity of resilin, a rubber-like protein”. J. Mol. Biol. 3 (5): 648–667. doi:10.1016/s0022-2836(61)80028-4.
- ^ Denny, M. W.; Gosline, J.M (1986). “The Structure and Properties of Spider Silk”. Endeavor 10: 37–43. doi:10.1016/0160-9327(86)90049-9.
- ^ Alberts, Bruce (2002). “Molecular Biology of the Cell, 4th edition”. Garland Science 4: 1–43.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002-01-01) (英語). The Plant Cell Wall.
- ^ Hu, Shihao (2012). “Rational Design and Nanofabrication of Gecko-Inspired Fibrillar Adhesives”. Nano Micro Small 8 (16): 2464–2468. doi:10.1002/smll.201200413. PMID 22641471.