テトラカルボニルニッケル
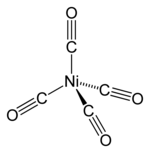
テトラカルボニルニッケル (英: tetracarbonylnickel) またはニッケルカルボニル (英: nickel carbonyl) は、ニッケルの一酸化炭素錯体である。化学式 Ni(CO)4 で表される、無色もしくは黄色で揮発性の液体である。毒性が非常に高く、「死の液体 (英: liquid death)」の異名を持つ。歴史、応用、理論の各方面で重要な化合物である。毒物及び劇物取締法により毒物に指定されている[3]。
| テトラカルボニルニッケル | |
|---|---|
| |

| |
tetracarbonylnickel(0) | |
別称 ニッケルカルボニル ニッケルテトラカルボニル | |
| 識別情報 | |
| CAS登録番号 | 13463-39-3 |
| EC番号 | 236-669-2 |
| RTECS番号 | QR6300000 |
| 特性 | |
| 化学式 | Ni(CO)4 |
| モル質量 | 170.7 g/mol |
| 外観 | 無色もしくは黄色の液体[1]、反磁性 |
| 匂い | かび臭い[1] |
| 密度 | 1.3 g/ml, 液体 |
| 融点 |
−19 °C |
| 沸点 |
43 °C |
| 水への溶解度 | 不溶 |
| 構造 | |
| 配位構造 | 四面体形 |
| 分子の形 | 四面体形 |
| 双極子モーメント | 0 D |
| 熱化学 | |
| 標準生成熱 ΔfH |
−632 kJ/mol |
| 標準燃焼熱 ΔcH |
−1180 kJ/mol |
| 標準モルエントロピー S |
320 J K−1 mol−1 |
| 危険性 | |
| 安全データシート(外部リンク) | ICSC 0064 MSDS (PDF) |
| GHSピクトグラム |    
|
| GHSシグナルワード | Danger [2] |
| Hフレーズ | H225, H300, H310, H330, H351, H360, H400, H410 |
| Pフレーズ | P201, P202, P210, P233, P240, P241, P242, P243, P260, P271, P273, P280, P281, P284 |
| NFPA 704 | |
| 引火点 | -20 °C |
| 発火点 | 60 °C |
| 関連する物質 | |
| 関連する金属カルボニル | ヘキサカルボニルクロム デカカルボニル二マンガン ペンタカルボニル鉄 オクタカルボニル二コバルト |
| 関連物質 | テトラキス(トリフェニルホスフィン)パラジウム(0) Ni(PF3)4 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
構造
編集他の多くの金属カルボニルと同じく18電子錯体である。金属カルボニルの有名な例として鉄カルボニルやモリブデンカルボニルが挙げられる。これらの化合物の特徴は金属とカルボニル配位子 CO の炭素原子との共有結合である。金属カルボニルは対称性の高い構造を持つため揮発性が高い。
合成法
編集金属ニッケルは室温で一酸化炭素 CO と反応してテトラカルボニル錯体を与える。暖かいガラス表面と接触させるなどして穏やかに加熱すると、分解して金属ニッケルと一酸化炭素に戻る。これらの反応はモンド法によって純粋なニッケルを得るための基礎的手法である。
反応
編集他の低原子価金属カルボニルと同様に CO の置換反応や酸化を受ける。トリフェニルホスフィン のような供与性の配位子と反応して や を与える。ビピリジンなどの配位子とも同様に反応する。これらの反応では、まず CO が脱離して高活性な16電子錯体 中間体となり、これに配位子が結合する。
塩素により酸化されて CO が脱離し塩化ニッケル(II) NiCl2 を与える。この反応はニッケルカルボニルを分解する簡単な方法である。
水酸化物イオンとの反応では還元されて や のようなクラスターが生成する。
有機合成においては、ハロゲン化アルキルやハロゲン化アリールとの反応がしばしばカルボニル化された有機化合物を合成するのに用いられる。PhCH=CHBr のようなハロゲン化ビニルは、ニッケルカルボニル、ナトリウムメトキシド NaOMe と順次反応させることによって不飽和エステルに変換される。これらの反応も Ni(CO)3 の発生と、これに対する酸化的付加を経て進行すると考えられている。
また、カルボニル配位子の炭素原子に対する求核攻撃も受ける。求核剤 (Nu−) と反応させるとアシル誘導体 が得られる。
毒性と安全に関する注意
編集ニッケルカルボニルは、労働安全衛生法の第2類特定化学物質に指定されている。
ニッケルカルボニルは特に体内で発生するニッケルの影響により、配位子として含まれている一酸化炭素よりも危険性が高いと考えられている。体内への吸収経路は吸入、経皮がある。 まず皮膚から吸収された場合、表面を強く刺激し火傷を生じる。吸引した場合は致命的である。その存在を臭いで感じることなく、重大な毒性の徴候や症状が現れることが知られている。ニッケルカルボニルによって引き起こされる急性毒性の主要な標的は肺であると考えられるが、肺以外の臓器の関与も報告されている[4]。蒸気は自然発火することがある。
中毒症状は2段階の症状によって特徴付けられる。第1期は数時間続く頭痛と胸の痛みで、通常すぐに収まる。第2期はおよそ16時間後に始まる間質性肺炎で、せき、息切れ、強い疲労感を伴う。これらの症状は4日後に最も重くなり、重症の場合には、肺水腫、チアノーゼなどになり,死亡するおそれがある。一心肺不全か腎不全によって死亡することが多い。回復期はしばしば著しく遅延し、疲労感、うつ病、呼吸困難との合併症もしばしば起こる。呼吸器への後遺症は一般的には見られない。発がん性については議論中であり、詳しくは知られていない。
有機金属反応剤ハンドブック(玉尾皓平編著、化学同人)によると、Ni(CO)4の作業環境の許容濃度は0.001ppmであり、シアン化水素ガス(10ppm)よりはるかに小さく、それだけ毒性が強いことを示している。
もし漏洩してしまった場合、火気厳禁とし、通風換気を十分に行ったうえで、保護具着用の上、破損箇所をシールし吸着材をまいて掃き取った後、大量の水で洗う。保護具としては自給式呼吸具、保護衣、保護メガネ、ゴム手袋、ゴム長靴などが推奨される[5]。
化学特性、分析方法
編集反応生成速度は遅いが、CO濃度 = CO分圧が高く、温度が77–117 °C付近で生成しやすい。
生成温度範囲は、−128–150 °Cと言われる。
CO 濃度が低く、水素が共存する場合には、メタネーション反応 (CO + 2H2 → CH4) が支配的である。基本的には、CO と Ni 金属が存在すれば生成すると言われ、アーク溶接作業や、SUS管に CO ガスを入れるだけでも発生する。
塩素や臭素、ヨウ素水溶液にニッケルカルボニルガスを通すことで素早く分解できる。また、パラジウム触媒による分解、ゼオライトによる吸着などの手法も知られている。
利用
編集- 電池用電極板の発泡金属(ニッケル)基材原料として利用される事がある[6]。
脚注
編集- ^ a b NIOSH Pocket Guide to Chemical Hazards-Nickel carbonyl、国立労働安全衛生研究所
- ^ Nickel Carbonyl
- ^ 毒物及び劇物取締法 昭和二十五年十二月二十八日 法律第三百三号 第二条 別表第一 二十
- ^ 急性曝露ガイドライン濃度 (PDF) 国立医薬品食品衛生研究所
- ^ ニッケルカルボニル (PDF) 神戸海難防止研究会
- ^ 稲澤信二、細江晃久、真嶋正利 ほか、発泡金属と新たなめっき技術 住友電工 SEIテクニカルレビュー 2010年7月号 No.177 (PDF)
参考文献
編集- Lascelles, K.; Morgan, L. G.; Nicholls, D. '"Nickel Compounds", Ullmann's Encyclopedia of Industrial Chemistry; John Wiley & Sons: New Jersey, 1991; vol. A17, chapt. 5, pp. 235–249.
- Encyclopedia of Reagents for Organic Synthesis; Paquette, L. A. ed.; John Wiley & Sons: New Jersey, 2003.
