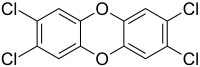
2,3,7,8-テトラクロロジベンゾジオキシン
2,3,7,8-テトラクロロジベンゾ-p-ジオキシン (TCDD) は、化学式C12H4Cl4O2で表されるポリ塩化ジベンゾ-p-ジオキシンの1つである。不正確ではあるが、単にダイオキシン (dioxin) と短縮されることもある[3]。純粋なTCDDは、室温で特異臭のない無色の固体である。これは通常、有機材料の燃焼過程で不要な生成物として、または有機合成で副産物として形成される。
| 2,3,7,8-テトラクロロジベンゾジオキシン | |
|---|---|
| |
| |
2,3,7,8-Tetrachlorooxanthrene | |
別称 2,3,7,8-Tetrachlorodibenzo[b,e][1,4]dioxine Tetradioxin Tetrachlorodibenzodioxin Tetrachlorodibenzo-p-dioxin | |
| 識別情報 | |
| CAS登録番号 | 1746-01-6 |
| PubChem | 15625 |
| ChemSpider | 14865 |
| |
| 特性 | |
| 化学式 | C12H4Cl4O2 |
| モル質量 | 321.97 g mol−1 |
| 外観 | 無色または白色結晶性固まり[1] |
| 密度 | 1.8 g/cm3 |
| 融点 |
305°C |
| 水への溶解度 | 0.2 μg/L[2] |
| 危険性 | |
| GHSピクトグラム |   
|
| GHSシグナルワード | DANGER |
| 主な危険性 | Developmental toxicant, Carcinogenic[1] |
| NFPA 704 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
TCDDは、その系列(PCDDまたは単にダイオキシンとして知られるポリ塩化ジベンゾジオキシン)の中で最も強毒性の化合物であり、ベトナム戦争で除草剤として使用されたオレンジ剤中の不純物として知られるようになった[4]。TCDDは、セベソ事故で環境中に放出された[5]。これは残留性有機汚染物質である。
作用機序
編集TCDDおよびダイオキシン様化合物は、すべての細胞に存在する特定の受容体 アリール炭化水素(AH)受容体を介して作用する[6][7][8]。この受容体は、遺伝子の遺伝子発現に関与する転写因子である。TCDDの多量投与は、ラットの数百の遺伝子の発現を増加または減少させることが示されている[9]。外来のしばしば毒性のある化合物の分解を活性化する酵素の遺伝子は、そのような遺伝子の典型的な例である(酵素誘導)。TCDDは、たとえばベンゾ[a]ピレンなどの発がん性多環式炭化水素を分解する酵素を増加させる[10]。
これらの多環式炭化水素も AH受容体を活性化するが、TCDD以下であり、一時的である[10]。野菜に含まれる多くの天然化合物でさえ、AH受容体の活性化を引き起こす[11][12]。この現象は、毒性および発がん性物質から生物を保護するため、適応性があり有益であると見なすことができる。しかし、AH受容体の過度かつ持続的な刺激は、多くの悪影響をもたらす[10]。
AH受容体の生理学的機能は継続的な研究の対象となっている[13]。明らかな機能の1つは、必要に応じて、体の外来化学物質または通常の化学物質を分解する酵素の活性を高めることである。しかし、さまざまな臓器や免疫系の発達やその他の調節機能に関連する機能は他にもたくさんあるらしい[13]。AH受容体は、系統発生的に高度に保存された転写因子であり、少なくとも 6億年の歴史があり、すべての脊椎動物に見られる。その古代の類似体は、より原始的な種においてさえ重要な調節タンパク質である[8]。まとめると、これは、正常な生理学的機能を達成するために、基礎的な程度の AH受容体活性化の必要性を意味する。
ヒトに対する毒性
編集2000年、世界保健機関(WHO)の専門家グループは、発生毒性を人類に対するダイオキシンの最も適切なリスクと見なした[14]。人々は通常、いくつかのダイオキシン様化学物質に同時にさらされるため、ダイオキシンおよびダイオキシン様化合物でより詳細な説明が提供される。
発達への影響
編集ベトナムと米国では、製造工程からの不純物として TCDDを含むオレンジ剤または2,4,5-Tに暴露された人の子供に催奇性または先天性欠損症が観察された。しかし、オレンジ剤/ダイオキシン暴露の間の因果関係にはいくつかの不確実性があった。2006年にメタアナリシスは研究間の大量の異質性を示し、この問題に関するコンセンサスの欠如を強調した[15]。死産、口蓋裂、および神経管閉鎖障害、二分脊椎症が最も統計的に有意な欠損であった。その後、いくつかの歯の欠陥と境界性の神経発達への影響が報告されている[3]。セベソ事故後、歯の発生障害、性比の変化と精子の質の低下が見られた[3]。ダイオキシンとダイオキシン様化合物への高混合暴露後、さまざまな発達上の影響が明確に示された。これは、日本と台湾でそれぞれ "Yusho disease"(カネミ油症事件)とYu-chen(台湾油症)の大災害で最も劇的である[3]。
発がん性
編集TCDDが変異原性または遺伝子毒性ではないことは概ね合意されている[16]。その主な作用は癌の促進である。それは他の化合物によって開始される発がん性を促進する。さらに、非常に高用量は間接的に癌を引き起こす可能性がある。提案されている機構の1つは、酸化ストレスとそれに続くDNAへの酸素損傷である[17]。内分泌かく乱やシグナル伝達の変化など、他にも説明がある[16][18]。内分泌かく乱作用はライフステージに依存しているようで、体内にエストロゲンが存在する(または高濃度で)場合は抗エストロゲン、エストロゲンが存在しない場合はエストロゲンである[19]。
TCDDは、国際がん研究機関によってヒトの発がん性物質として分類された(グループ1) [20][21]。分類に利用できる職業コホート研究では、非常に高い暴露でもリスクは弱く、境界線で検出可能であった[22][23][3]。したがって、分類は、本質的に、動物実験と機構的考察に基づいていた[20]。これは、IARCの1997年の分類規則からの逸脱として批判された[24]。IARC分類の主な問題は、定性的ハザード、つまり任意の用量での発がん性のみを評価し、さまざまな用量での定量的リスクを評価してないことである[3]。2006年の「Molecular Nutrition & Food Research」の記事によると、TCDDが高用量でのみ発がん性であり、組織の毒性損傷も引き起こすかどうかについての議論があった[16][17][25]。2011年のレビューでは、1997年以降、さらなる研究は TCDD暴露とがんリスクとの関連を支持しなかったと結論付けた[26]。問題の1つは、すべての職業研究において、被験者がTCDDだけでなく多数の化学物質にさらされていることである。2011年までに、ランチハンド作戦からのベトナム退役軍人研究の更新を含む研究は、30年後の結果は病気の証拠を提供しなかったと結論付けたと報告された[27]。一方、セベソの人口に関する最新の研究は、高用量でのTCDD発がん性を裏付けていている[19][28]。
2004年、International Journal of Cancerの記事は、TCDDまたは他のダイオキシンが低用量で軟部組織肉腫を引き起こしていないという直接的な疫学的証拠を提供したが、このがんはダイオキシンに典型的であると考えられている。実際、がんは減少する傾向があった[29] ジャーナル「Dose-Response」の2005年の記事によると、これはJ字型の用量反応と呼ばれ、低用量ではリスクが減少し、高用量でのみリスクが増加する[30]
安全に関する推奨事項
編集2001年にFAO / WHO合同食品添加物専門家委員会(JECFA)が、70 pg TEQ/kg体重の暫定許容月間摂取量(PTMI)を導き出した[31]。アメリカ合衆国環境保護庁(EPA)は TCDDの1日あたりの経口参照用量(RfD) として0.7 pg/kg体重を確立した[32](違いに関する議論を参照)[3])アスペン研究所によると、2011年には、ほとんどの国の一般的な環境制限は、土壌で1,000 ppt TEQ、堆積物で100 pptである。ほとんどの先進工業国では、土壌中のダイオキシン濃度は12 ppt未満である。米国有害物質疾病登録局は、土壌中の1,000 ppt TEQを超えるレベルには、研究、監視、健康調査、地域社会および医師の教育、暴露調査などの介入が必要であると判断した。EPAは、これらの制限を72 ppt TEQに減らすことを検討している。この変化は、処理を必要とする汚染土壌の潜在的な量を大幅に増加させるだろう[33][34]。
動物毒性学
編集ダイオキシン様化学物質の毒性に関するほとんどの情報は、TCDDを利用した動物実験に基づいている[4][8][35][36]。ほとんどすべての臓器は、高用量のTCDDの影響を受ける。動物を対象とした短期毒性試験では、典型的な影響は食欲不振と消耗であり、大量投与後でも、TCDD投与後わずか1 - 6週間で動物が死亡する[36]。一見類似した種は、急性の影響に対してさまざまな感受性を持っている。モルモットの致死量は約1 μg/kgだが、ハムスターの致死量は1,000 μg/kgを超える。2つの異なるラット系統間でも同様の違いが見られる[36]。さまざまな過形成(異常増殖)または萎縮性(消耗)反応がさまざまな臓器で見られる。胸腺萎縮は、いくつかの動物種で非常に典型的である。TCDDはいくつかのホルモンのバランスにも影響を与える。すべてではないが、一部の種では重度の肝毒性が見られる[8][36]。現在の人口におけるダイオキシンの低用量を考慮に入れると、発生毒性とがん[3][8]の2種類の毒性作用のみがヒトに関連するリスクを引き起こすと考えられている。
発達への影響
編集発達への影響は、動物では非常に低用量で発生する。それらには、口蓋裂や水腎症などの端的な催奇形性が含まれる[37]。一部の臓器の発達はさらに敏感である可能性がある:非常に低用量はげっ歯類[37][38][39]の性器の発達とラットの歯の発達を妨げる[40]。後者は、セベソ事故後[41]、そしておそらくヨーロッパのダイオキシン濃度が現在の約10倍であった1970年代と1980年代の乳児の長い母乳育児の後にも歯の変形が見られたという点で重要である[42]。
発がん性
編集がんは多くの場所で動物に誘発される可能性がある。十分に高い用量では、TCDDは試験したすべての動物にがんを引き起こした。最も敏感なのは雌ラットの肝臓がんであり、これは長い間リスク評価の基礎となっている[43]。がんを引き起こすことにおける TCDDの用量反応は線形ではないようであり[25]、それ以下ではがんを引き起こさないと思われる閾値がある。TCDDには変異原性または遺伝子毒性がなく、言い換えれば、がんを開始することができず、がんのリスクは、他の化合物によって開始されたがんの促進[16]、または体の防御機構の妨害などの間接的な影響に基づいている。つまり、アポトーシス(変異細胞のプログラム化された死)を防ぐことによって[23][7]。発がん性は組織の損傷に関連しており、現在では組織の損傷に続いて起こると見なされることがよくある[16]。
発生源
編集TCDDは、科学研究用の純粋な化学物質として以外、商業的に生産されたことはない。ただし、特定のクロロフェノールまたはクロロフェノキシ酸系除草剤を製造すると、合成副産物として生成される[44]。
また、特に銅などの特定の金属触媒が存在する場合、塩素が存在する炭化水素の燃焼において、他のポリ塩化ジベンゾジオキシンおよびポリ塩化ジベンゾフランと一緒に形成される可能性がある[45]。通常、ダイオキシン様化合物の混合物が生成される[3]。したがって、より徹底的な論文がダイオキシンおよびダイオキシン様化合物の下にある。
最大の生成は、廃棄物の焼却、金属の生産、化石燃料と木材の燃焼である[46]。ダイオキシンの生成は通常、燃焼温度を上げることで減らすことができる。PCCD/Fsの米国での総排出量は 1987年の約14 kg TEQから2000年の1.4 kg TEQに減少した[47]。
暴露の事例
編集人々が高用量のTCDDにさらされた多くの事件があった。
- 1976年、イタリアのセベソの何千人もの住民が、圧力タンクから洩れた数キログラムのTCDDにさらされた。多くの動物が死亡し、特に外で遊んで地元の食べ物を食べている子供たちの脂肪中に、最大56,000 pg/gという高濃度のTCDDが認められた。急性の影響はクロロアクネの約200例に限定されていた[48]。長期的な影響には、多発性骨髄腫および骨髄性白血病のわずかな増加[19]、ならびに歯の発達障害や、暴露された父親から生まれた子供の女児の増加などのいくつかの発達上の影響があるらしい[49]。他のいくつかの長期的な影響が疑われているが、証拠はそれほど強力ではない[5]。
- ミズーリ州のタイムズビーチで、ラッセルマーティンブリスによって数百人が非常に高濃度のTCDDで中毒させられた。ラッセルマーティンブリスは、道路のほこりを鎮めるため、オレンジ剤を製造したNEPACCO社から入手したTCDDをほこりの多い道路に噴霧した。この事件に関して誰も起訴されたことはなく、タイムズビーチ市はアメリカ疾病予防管理センター(CDC)およびアメリカ合衆国環境保護庁(EPA)による調査の結果、放棄され、不問に付された。これは、米国の歴史の中でTCDDによる民間地域の単一の最大の汚染として印されている。
- ウィーンで、1997年に2人の女性が職場で中毒になり、そのうちの1人で測定された濃度は、人間で測定された史上最高の144,000 pg/g(脂肪)であった。これは、今日のほとんどの人の濃度の約10万倍であり、今日の若者のすべてのダイオキシン様化合物の合計の約1万倍にあたる。彼らは生き残ったが、数年間困難なクロロアクネに苦しんだ。中毒は1997年10月に発生した可能性が高いが、1998年4月まで発見されなかった。女性が秘書として働いていた研究所では、高濃度のTCDDが研究室の1つで発見され、化合物がそこで生産されたことを示唆している。警察の捜査では犯罪の明確な証拠を見つけることができず、誰も起訴されなかった。倦怠感と無月経を除いて、他の症状や異常な検査所見はほとんど無かった[50]。
- 2004年、ウクライナの大統領候補ヴィクトル・ユシチェンコは大量のTCDDで中毒させられた。彼の血中TCDD濃度は108,000 pg/g(脂肪)と測定され[51]、これはこれまでに測定された2番目に高い濃度である。この濃度は、2 mgまたは25 μg/kg(体重)を超える用量を意味する。彼は長年クロロアクネに苦しんでいたが、最初の倦怠感の後、他の症状や異常な検査所見はほとんど無かった[51]。
- 死の三角形(イタリア)として知られるイタリアの汚染された土地の地域は、組織犯罪による長年の違法な廃棄物処理からTCDDで汚染されている[52][53][54]。
脚注
編集- ^ a b NIOSH Pocket Guide to Chemical Hazards 0594
- ^ Shiu WY (1988). “Physical-chemical properties of chlorinated dibenzo-p-dioxins”. Environ Sci Technol 22 (6): 651–658. Bibcode: 1988EnST...22..651S. doi:10.1021/es00171a006.
- ^ a b c d e f g h i Tuomisto, Jouko (2019). “Dioxins and dioxin-like compounds: toxicity in humans and animals, sources, and behaviour in the environment”. WikiJournal of Medicine 6 (1): 8. doi:10.15347/wjm/2019.008.
- ^ a b “Dioxins: an overview”. Environ. Res. 101 (3): 419–28. (2006). Bibcode: 2006ER....101..419S. doi:10.1016/j.envres.2005.12.003. PMID 16445906.
- ^ a b M.H. Sweeney; P. Mocarelli (2000). “Human health effects after exposure to 2,3,7,8- TCDD”. Food Addit. Contam. 17 (4): 303–316. doi:10.1080/026520300283379. PMID 10912244.
- ^ L. Poellinger (2000). “Mechanistic aspects—the dioxin (aryl hydrocarbon) receptor.”. Food Additives and Contaminants 17 (4): 261–6. doi:10.1080/026520300283333. PMID 10912240.
- ^ a b Mandal PK (May 2005). “Dioxin: a review of its environmental effects and its aryl hydrocarbon receptor biology”. J. Comp. Physiol. B 175 (4): 221–30. doi:10.1007/s00360-005-0483-3. PMID 15900503.
- ^ a b c d e J. Lindén; S. Lensu; J. Tuomisto; R. Pohjanvirta. (2010). “Dioxins, the aryl hydrocarbon receptor and the central regulation of energy balance. A review.”. Frontiers in Neuroendocrinology 31 (4): 452–478. doi:10.1016/j.yfrne.2010.07.002. PMID 20624415.
- ^ “Hydrocarbon receptor regulates distinct dioxin-dependent and dioxin-independent gene batteries”. Molecular Pharmacology 69 (1): 140–153. (2006). doi:10.1124/mol.105.018705. PMID 16214954.
- ^ a b c Okey AB (July 2007). “An aryl hydrocarbon receptor odyssey to the shores of toxicology: the Deichmann Lecture, International Congress of Toxicology-XI”. Toxicol. Sci. 98 (1): 5–38. doi:10.1093/toxsci/kfm096. PMID 17569696.
- ^ “Modulation of metabolic enzymes by dietary phytochemicals: a review of mechanisms underlying beneficial versus unfavorable effects”. Curr. Drug Metab. 7 (6): 661–75. (August 2006). doi:10.2174/138920006778017795. PMID 16918318.
- ^ DeGroot, Danica; He, Guochun; Fraccalvieri, Domenico; Bonati, Laura; Pandini, Allesandro; Denison, Michael S. (2011). “AHR Ligands: Promiscuity in Binding and Diversity in Response” (英語). The AH Receptor in Biology and Toxicology. John Wiley & Sons, Ltd. pp. 63–79. doi:10.1002/9781118140574.ch4. ISBN 9781118140574
- ^ a b Rothhammer, V; Quintana, FJ (March 2019). “The aryl hydrocarbon receptor: an environmental sensor integrating immune responses in health and disease.”. Nature Reviews. Immunology 19 (3): 184–197. doi:10.1038/s41577-019-0125-8. PMID 30718831.
- ^ “Consultation on assessment of the health risk of dioxins: re-evaluation of the tolerable daily intake (TDI): Executive summary”. Food Additives & Contaminants 17 (4): 223–240. (2000). doi:10.1080/713810655. PMID 10912238.
- ^ Ngo, Anh D; Taylor, Richard; Roberts, Christine L; Nguyen, Tuan V (2006). “Association between Agent Orange and birth defects: Systematic review and meta-analysis”. International Journal of Epidemiology 35 (5): 1220–1230. doi:10.1093/ije/dyl038. PMID 16543362.
- ^ a b c d e Y.P. Dragan; D. Schrenk (2000). “Animal studies addressing the carcinogenicity of TCDD (or related compounds) with an emphasis on tumour promotion”. Food Additives and Contaminants 17 (4): 289–302. doi:10.1080/026520300283360. PMID 10912243.
- ^ a b M. Viluksela (2000). “Liver tumor-promoting activity of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) in TCDD-sensitive and TCDD resistant rat strains”. Cancer Res. 60 (24): 6911–20. PMID 11156390.
- ^ “Carcinogenicity of 2,3,7,8-tetrachlorodibenzo-p-dioxin in experimental models”. Mol Nutr Food Res 50 (10): 897–907. (October 2006). doi:10.1002/mnfr.200600006. PMID 16977593.
- ^ a b c Angela Cecilia Pesatori; Dario Consonni; Maurizia Rubagotti; Paolo Grillo; Pier Alberto Bertazzi (2009). “Cancer incidence in the population exposed to dioxin after the "Seveso accident": twenty years of follow-up”. Environmental Health 8 (1): 39. doi:10.1186/1476-069X-8-39. PMC 2754980. PMID 19754930.
- ^ a b International Agency for Research on Cancer (1997). Polychlorinated dibenzo-para-dioxins and polychlorinated dibenzofurans. Monographs on the Evaluation of Carcinogenic Risks to Humans. 69. Lyon: IARC. ISBN 978-92-832-1269-0
- ^ IARC Working Group on the Evaluation of Carcinogenic Risk to Humans (2012) (英語). 2,3,7,8-tetrachlorodibenzopara-dioxin, 2,3,4,7,8-pentachlorodibenzofuran, and 3,3',4,4',5-pentachlorobiphenyl. 100F. International Agency for Research on Cancer. pp. 339–378
- ^ “Cancer mortality in workers exposed to phenoxy herbicides, chlorophenols, and dioxins”. Am J Epidemiol 145 (12): 1061–1075. (1997). doi:10.1093/oxfordjournals.aje.a009069. PMID 9199536.
- ^ a b “Carcinogenic risks of dioxin: mechanistic considerations”. Regul. Toxicol. Pharmacol. 43 (1): 19–34. (October 2005). doi:10.1016/j.yrtph.2005.05.008. PMID 16054739.
- ^ “Dioxin and cancer: a critical review”. Regul. Toxicol. Pharmacol. 38 (3): 378–88. (December 2003). doi:10.1016/j.yrtph.2003.08.002. PMID 14623487.
- ^ a b “Comparison of chronic toxicity and carcinogenicity of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) in 2-year bioassays in female Sprague-Dawley rats”. Mol Nutr Food Res 50 (10): 934–944. (October 2006). doi:10.1002/mnfr.200600031. PMC 1934421. PMID 16977594.
- ^ “TCDD and cancer: a critical review of epidemiologic studies”. Crit. Rev. Toxicol. 41 (7): 622–636. (August 2011). doi:10.3109/10408444.2011.560141. PMC 3154583. PMID 21718216.
- ^ “The Air Force health study: an epidemiologic retrospective”. Ann Epidemiol 21 (9): 673–687. (September 2011). doi:10.1016/j.annepidem.2011.02.001. PMID 21441038.
- ^ Warner, M; Mocarelli, P; Samuels, S; Needham, L; Brambilla, P; Eskenazi, B (December 2011). “Dioxin exposure and cancer risk in the Seveso Women's Health Study.”. Environmental Health Perspectives 119 (12): 1700–1705. doi:10.1289/ehp.1103720. PMC 3261987. PMID 21810551.
- ^ J.T. Tuomisto; J. Pekkanen; H. Kiviranta; E. Tukiainen; T. Vartiainen; J. Tuomisto (2004). “Soft-tissue sarcoma and dioxin: a case-control study”. Int. J. Cancer 108 (6): 893–900. doi:10.1002/ijc.11635. PMID 14712494.
- ^ Tuomisto, J. (2005). “Dioxin cancer risk –example of hormesis?”. Dose-Response 3 (3): 332–341. doi:10.2203/dose-response.003.03.004. PMC 2475943. PMID 18648613.
- ^ Malisch R, Kotz A (2014). “Dioxins and PCBs in feed and food--review from European perspective.”. The Science of the Total Environment 491–492: 2–10. Bibcode: 2014ScTEn.491....2M. doi:10.1016/j.scitotenv.2014.03.022. PMID 24804623.
- ^ Rice, Glenn. “EPA's Reanalysis of Key Issues Related to Dioxin Toxicity and Response to NAS Comments (External Review Draft)” (英語). cfpub.epa.gov. US EPA National Center for Environmental Assessment,Cincinnati Oh. 2019年12月16日閲覧。
- ^ “Health Effects”. The Aspen Institute (August 2011). 23 September 2019閲覧。
- ^ “Toxic Substances Portal”
- ^ A. Poland; J.C. Knutson (1982). “2,3,7,8-Tetrachlorodibenzo-p-dioxin and related halogenated aromatic hydrocarbons: examination of the mechanism of toxicity”. Annu. Rev. Pharmacol. Toxicol. 22 (1): 517–554. doi:10.1146/annurev.pa.22.040182.002505. PMID 6282188.
- ^ a b c d R. Pohjanvirta; J. Tuomisto (1994). “Short-term toxicity of 2,3,7,8-tetrachlorodibenzop-dioxin in laboratory animals: effects, mechanisms, and animal models”. Pharmacol. Rev. 46 (4): 483–549. PMID 7899475.
- ^ a b L.S. Birnbaum; J. Tuomisto (2000). “Non-carcinogenic effects of TCDD in animals”. Food Addit. Contam. 17 (4): 275–288. doi:10.1080/026520300283351. PMID 10912242.
- ^ T.A. Mably; D.L. Bjerke; R.W. Moore; A. Gendron-Fitzpatrick; R.E. Peterson (1992). “In utero and lactational exposure of male rats to 2,3,7,8-tetrachlorodibenzo-pdioxin. 3. Effects on spermatogenesis and reproductive capability”. Toxicol. Appl. Pharmacol. 114 (1): 118–126. doi:10.1016/0041-008X(92)90103-Y. PMID 1585364.
- ^ L.E. Gray; J.S. Ostby; W.R. Kelce (1997). “A dose-response analysis of the reproductive effects of a single gestational dose of 2,3,7,8-tetrachlorodibenzo-p-dioxin in male Long Evans Hooded rat offspring”. Toxicol. Appl. Pharmacol. 146 (1): 11–20. doi:10.1006/taap.1997.8223. PMID 9299592.
- ^ H. Kattainen (2001). “In utero/lactational 2,3,7,8- tetrachlorodibenzo-p-dioxin exposure impairs molar tooth development in rats”. Toxicol. Appl. Pharmacol. 174 (3): 216–224. doi:10.1006/taap.2001.9216. PMID 11485382.
- ^ S. Alaluusua (2004). “Developmental dental aberrations after the dioxin accident in Seveso”. Environ. Health Perspect. 112 (13): 1313–1318. doi:10.1289/ehp.6920. PMC 1247522. PMID 15345345.
- ^ S. Alaluusua; P.L. Lukinmaa; J. Torppa; J. Tuomisto; T. Vartiainen (1999). “Developing teeth as biomarker of dioxin exposure”. Lancet 353 (9148): 206. doi:10.1016/S0140-6736(05)77214-7. PMID 9923879.
- ^ R.J. Kociba (1978). “Results of a two-year chronic toxicity and oncogenicity study of 2,3,7,8- tetrachlorodibenzo-p-dioxin in rats”. Toxicol. Appl. Pharmacol. 46 (2): 279–303. doi:10.1016/0041-008X(78)90075-3. PMID 734660.
- ^ Saracci, R.; Kogevinas, M.; Winkelmann, R.; Bertazzi, P. A.; Bueno De Mesquita, B. H.; Coggon, D.; Green, L. M.; Kauppinen, T. et al. (1991). “Cancer mortality in workers exposed to chlorophenoxy herbicides and chlorophenols”. The Lancet 338 (8774): 1027–1032. doi:10.1016/0140-6736(91)91898-5. PMID 1681353.
- ^ Harnly, M.; Stephens, R.; McLaughlin, C.; Marcotte, J.; Petreas, M.; Goldman, L. (1995). “Polychlorinated Dibenzo-p-dioxin and Dibenzofuran Contamination at Metal Recovery Facilities, Open Burn Sites, and a Railroad Car Incineration Facility”. Environmental Science & Technology 29 (3): 677–684. Bibcode: 1995EnST...29..677H. doi:10.1021/es00003a015. PMID 22200276.
- ^ DHHS: Report on Carcinogens, Twelfth Edition (2011) Archived 17 February 2013 at the Wayback Machine. (accessed 2013-08-01)
- ^ Jouko Tuomisto &al.: Synopsis on Dioxins and PCBs Archived 27 September 2011 at the Wayback Machine. (accessed 2013-08-01), p.40; using data from EPA's National Center for Environmental Assessment
- ^ P. Mocarelli (1991). “Serum concentrations of 2,3,7,8- tetrachlorodibenzo-p-dioxin and test results from selected residents of Seveso, Italy”. J. Toxicol. Environ. Health 32 (4): 357–366. doi:10.1080/15287399109531490. PMID 1826746.
- ^ P. Mocarelli (2000). “Paternal concentrations of dioxin and sex ratio of offspring”. Lancet 355 (9218): 1858–1863. doi:10.1016/S0140-6736(00)02290-X. hdl:10281/16136. PMID 10866441.
- ^ A. Geusau; K. Abraham; K. Geissler; M.O. Sator; G. Stingl; E. Tschachler (2001). “Severe 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) intoxication: clinical and laboratory effects”. Environ. Health Perspect. 109 (8): 865–869. doi:10.1289/ehp.01109865. PMC 1240417. PMID 11564625.
- ^ a b Sorg, O.; Zennegg, M.; Schmid, P.; Fedosyuk, R.; Valikhnovskyi, R.; Gaide, O.; Kniazevych, V.; Saurat, J.-H. (2009). “2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) poisoning in Victor Yushchenko: identification and measurement of TCDD metabolites”. The Lancet 374 (9696): 1179–1185. doi:10.1016/S0140-6736(09)60912-0. PMID 19660807.
- ^ Senior, K; Mazza, A (Sep 2004). “Italian "Triangle of death" linked to waste crisis”. Lancet Oncol 5 (9): 525–527. doi:10.1016/s1470-2045(04)01561-x. PMID 15384216.
- ^ “Il triangolo della morte”. rassegna.it. March 2007閲覧。
- ^ “Discariche piene di rifiuti tossici quello è il triangolo della morte”. la Repubblica. 31 August 2004閲覧。
