ギルテリチニブ
(ギリテルチニブから転送)
ギルテリチニブ (英語: Gilteritinib) は、急性骨髄性白血病の治療薬のひとつ[1]。 変異を起こしたFLT3チロシンキナーゼを阻害することで作用する[2]。
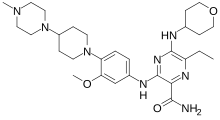 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | ゾスパタ |
| 法的規制 |
|
| 薬物動態データ | |
| 血漿タンパク結合 | 約90% |
| 代謝 | 肝代謝(CYP3A4) |
| 半減期 | 84~126時間 |
| 識別 | |
| CAS番号 | 1254053-43-4 |
| PubChem | CID: 49803313 |
| UNII | 66D92MGC8M |
| 化学的データ | |
| 化学式 | C29H44N8O3 |
| 分子量 | 552.72 g·mol−1 |
| |
アステラス製薬により開発された。2018年4月に、アステラス製薬は米国食品医薬品管理局 に成人FLT3変異陽性の再発または難治性急性骨髄性白血病 (AML) に対しての承認を申請し[3]、同年11月に承認された[4]。日本では、2018年11月20日に薬価収載された[5]。製品名はゾスパタ。
効能又は効果
編集- 再発又は難治性のFLT3遺伝子変異陽性の急性骨髄性白血病。
作用機序
編集- ギルテリチニブは、FLT3等のチロシンキナーゼに対する阻害作用を示す。FLT3を介したシグナル伝達を阻害することにより、FLT3遺伝子変異(FLT3-ITD及びFLT3-TKD(D835Y))による異常に活性化した腫瘍細胞の増殖シグナルを抑制する。
参考文献
編集- ^ Perl, Alexander E.; Altman, Jessica K.; Cortes, Jorge; Smith, Catherine; Litzow, Mark; Baer, Maria R.; Claxton, David; Erba, Harry P. et al. (2017). “Selective inhibition of FLT3 by gilteritinib in relapsed or refractory acute myeloid leukaemia: A multicentre, first-in-human, open-label, phase 1–2 study”. The Lancet Oncology 18 (8): 1061–1075. doi:10.1016/S1470-2045(17)30416-3. PMC 5572576. PMID 28645776.
- ^ Lee, Lauren Y.; Hernandez, Daniela; Rajkhowa, Trivikram; Smith, Samuel C.; Raman, Jayant Ranganathan; Nguyen, Bao; Small, Donald; Levis, Mark (2017). “Preclinical studies of gilteritinib, a next-generation FLT3 inhibitor”. Blood 129 (2): 257–260. doi:10.1182/blood-2016-10-745133. PMC 5234222. PMID 27908881.
- ^ “FDA Approval Sought for Gilteritinib in FLT3+ AML”. onclive.com. (April 24, 2018) September 29, 2018閲覧。
- ^ “FDA approves gilteritinib for relapsed or refractory acute myeloid leukemia (AML) with a FLT3 mutatation”. Drugs. FDA (December 14, 2018). July 21, 2023閲覧。
- ^ 新医薬品一覧表 厚生労働省 2021年4月10日閲覧。