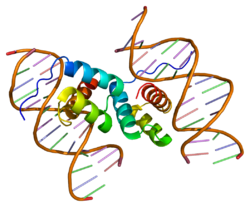
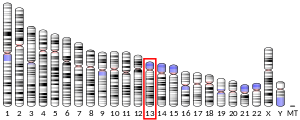
PDX1
PDX1(pancreatic and duodenal homeobox 1)またはIPF1(insulin promoter factor 1)は、ParaHox遺伝子クラスター[5]中のPDX1遺伝子にコードされる転写因子である[6][7]。脊椎動物では、Pdx1はβ細胞の成熟など膵臓の発生過程や、十二指腸の分化に必要である。この遺伝子はアフリカツメガエルXenopus laevisで同定され[8]、左右相称動物に広く存在するが、節足動物と線形動物では進化の過程で失われている[5]。Pdx1という名称がつけられているものの、大部分の動物にはPdx2遺伝子は存在せず、全ての哺乳類でPdx1のオルソログ1コピーのみが同定されている[9]。これまでに、シーラカンスと軟骨魚類のみが2つのPdx遺伝子、Pdx1とPdx2を持つことが示されている[10]。
機能
編集膵臓の発生
編集膵臓の発生過程において、PDX1は胚体内胚葉の後方前腸領域の細胞集団で発現しており、PDX1+上皮細胞は膵芽、そして最終的には膵臓全体(外分泌、内分泌、膵管細胞集団)の発生をもたらす[11]。マウス胚では、膵臓のPdx1+細胞は胎生8.5–9.0日(E8.5–9.0)に初めて発生し、Pdx1の発現はE12.0–12.5まで継続する[12]。ホモ接合型Pdx1ノックアウトマウスでは膵芽は形成されるものの、膵臓の発生は行われない[13]。また、テトラサイクリンによってPdx1+細胞が致死となるよう改変されたトランスジェニックマウスでは、妊娠期間を通じてドキシサイクリン(テトラサイクリン誘導体)を投与された場合にほぼ完全に膵臓を欠損することからも、膵臓発生におけるPdx1+細胞の必要性が強調される[12]。
PDX1は膵臓発生の最初期のマーカーであると考えられており、膵臓細胞の運命はその下流の転写因子によって制御されている[13]。発生過程で最初に形成される膵芽は、HLXB9、HNF6、PTF1A、NKX6-1を共発現するPDX1+膵臓前駆細胞から構成されている。これらの細胞はFGF10シグナルに応答してさらに増殖し、分岐する。その後、膵臓細胞の分化が開始され、Notchシグナルが阻害された細胞集団はNGN3を発現する。このNGN3+集団は一過的に膵臓内分泌細胞前駆細胞集団となり、ランゲルハンス島のα、β、Δ、PP、ε細胞の発生をもたらす[12]。その他の細胞は外分泌細胞や膵管細胞の集団を生じさせることとなる。
β細胞の成熟と生存
編集膵臓の発生の最終段階は、インスリンを産生するβ細胞やグルカゴンを産生するα細胞など、さまざまな内分泌細胞の形成である。PDX1はβ細胞の成熟に必要であり、発生中のβ細胞でのPDX1、NKX6-1、インスリンの共発現によって、β細胞の成熟に必要なスイッチである、MAFBのサイレンシングとMAFAの発現が引き起こされる[11]。この段階でPDX1の発現を実験的に低下させると、産生されるβ細胞の数は少なくなり、関連してα細胞数が増加する[14]。
成熟した膵臓では、PDX1の発現はβ細胞の維持と生存に必要であるようである。この段階でPDX1の発現レベルを実験的に低下させるとβ細胞のグルカゴン産生量が高まり[15]、このことはPDX1がβ細胞からα細胞への転換を阻害していることを示唆している。さらに、PDX1はβ細胞のアポトーシスに対するインスリンの作用の媒介にも重要であるようであり、β細胞は少量のインスリンによってアポトーシスから保護されるものの、PDX1の発現が阻害された細胞ではこうした効果がみられない[16][17]。
十二指腸
編集PDX1は、近位十二指腸の発生と胃十二指腸境界の維持に必要である[18]。十二指腸の腸細胞、ブルンネル腺、腸管内分泌細胞(幽門部のものも含む)はPDX1の発現に依存している。PDX1はSOX2やCDX2とともに、前腸部の適切な細胞分化を決定する[18]。成体のマウスの十二指腸では、Pdx1の発現に依存する遺伝子がいくつか同定されており、その一部は脂質や鉄の吸収に影響している[19]。
病理
編集動物モデルでの実験では、Pdx1の発現低下によって1型糖尿病や2型糖尿病に特徴的な症状が引き起こされることが示されている[20]。さらに、胃がんではPDX1の発現が失われており、がん抑制遺伝子としての役割が示唆される[21]。若年発症成人型糖尿病4型(MODY 4)は、PDX1のヘテロ接合型変異によって引き起こされる[22][23]。2型糖尿病症状に対する感受性が高い種であるデブスナネズミPsammomys obesusは、他の哺乳類と比較してPdx1遺伝子の配列が高度に多様化している[24]。
相互作用
編集出典
編集- ^ a b c GRCh38: Ensembl release 89: ENSG00000139515 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000029644 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ a b Brooke, N. M.; Garcia-Fernàndez, J.; Holland, P. W. (1998-04-30). “The ParaHox gene cluster is an evolutionary sister of the Hox gene cluster”. Nature 392 (6679): 920–922. doi:10.1038/31933. ISSN 0028-0836. PMID 9582071.
- ^ “PDX1”. HGNC. 22 April 2016閲覧。
- ^ “Localization of human homeodomain transcription factor insulin promoter factor 1 (IPF1) to chromosome band 13q12.1”. Genomics 28 (1): 125–6. (July 1995). doi:10.1006/geno.1995.1120. PMID 7590740.
- ^ Wright, C. V.; Schnegelsberg, P.; De Robertis, E. M. (1989-04). “XlHbox 8: a novel Xenopus homeo protein restricted to a narrow band of endoderm”. Development (Cambridge, England) 105 (4): 787–794. doi:10.1242/dev.105.4.787. ISSN 0950-1991. PMID 2574662.
- ^ “OrthoMaM phylogenetic marker: PDX1 coding sequence”. OrthoMam v10 (2019年). 24 February 2019閲覧。
- ^ “Parallel retention of Pdx2 genes in cartilaginous fish and coelacanths”. Molecular Biology and Evolution 27 (10): 2386–91. (October 2010). doi:10.1093/molbev/msq121. PMC 2944030. PMID 20463047.
- ^ a b “Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells”. Nat. Biotechnol. 24 (11): 1392–401. (November 2006). doi:10.1038/nbt1259. PMID 17053790.
- ^ a b c “Organ size is limited by the number of embryonic progenitor cells in the pancreas but not the liver”. Nature 445 (7130): 886–91. (February 2007). Bibcode: 2007Natur.445..886S. doi:10.1038/nature05537. PMID 17259975.
- ^ a b “PAX4 enhances beta-cell differentiation of human embryonic stem cells”. PLOS ONE 3 (3): e1783. (2008). Bibcode: 2008PLoSO...3.1783L. doi:10.1371/journal.pone.0001783. PMC 2262135. PMID 18335054.
- ^ Gannon, Maureen; Ables, Elizabeth Tweedie; Crawford, Laura; Lowe, David; Offield, Martin F.; Magnuson, Mark A.; Wright, Christopher V. E. (2008-02-15). “pdx-1 function is specifically required in embryonic beta cells to generate appropriate numbers of endocrine cell types and maintain glucose homeostasis”. Developmental Biology 314 (2): 406–417. doi:10.1016/j.ydbio.2007.10.038. ISSN 1095-564X. PMC 2269701. PMID 18155690.
- ^ Ahlgren, U.; Jonsson, J.; Jonsson, L.; Simu, K.; Edlund, H. (1998-06-15). “beta-cell-specific inactivation of the mouse Ipf1/Pdx1 gene results in loss of the beta-cell phenotype and maturity onset diabetes”. Genes & Development 12 (12): 1763–1768. doi:10.1101/gad.12.12.1763. ISSN 0890-9369. PMC PMC316911. PMID 9637677.
- ^ “Increased islet apoptosis in Pdx1+/- mice”. J. Clin. Invest. 111 (8): 1147–60. (April 2003). doi:10.1172/JCI16537. PMC 152933. PMID 12697734.
- ^ “Insulin protects islets from apoptosis via Pdx1 and specific changes in the human islet proteome”. Proc. Natl. Acad. Sci. U.S.A. 103 (51): 19575–80. (December 2006). Bibcode: 2006PNAS..10319575J. doi:10.1073/pnas.0604208103. PMC 1748267. PMID 17158802.
- ^ a b “The Parahox gene Pdx1 is required to maintain positional identity in the adult foregut”. Int. J. Dev. Biol. 57 (5): 391–8. (2013). doi:10.1387/ijdb.120048ah. PMID 23873371.
- ^ “Expression profiling identifies novel gene targets and functions for Pdx1 in the duodenum of mature mice”. Am. J. Physiol. Gastrointest. Liver Physiol. 302 (4): G407–19. (2012). doi:10.1152/ajpgi.00314.2011. PMC 3287393. PMID 22135308.
- ^ Fujimoto, K.; Polonsky, K. S. (2009-11). “Pdx1 and other factors that regulate pancreatic beta-cell survival”. Diabetes, Obesity & Metabolism 11 Suppl 4 (Suppl 4): 30–37. doi:10.1111/j.1463-1326.2009.01121.x. ISSN 1463-1326. PMC 2802270. PMID 19817786.
- ^ “Pancreatic duodenal homeobox-1 (PDX1) functions as a tumor suppressor in gastric cancer”. Carcinogenesis 29 (7): 1327–33. (2008). doi:10.1093/carcin/bgn112. PMID 18477649.
- ^ “Entrez Gene: PDX1 pancreatic and duodenal homeobox 1”. 2023年6月11日閲覧。
- ^ “Molecular mechanisms and clinical pathophysiology of maturity-onset diabetes of the young”. N. Engl. J. Med. 345 (13): 971–80. (September 2001). doi:10.1056/NEJMra002168. PMID 11575290.
- ^ “Genome sequence of a diabetes-prone rodent reveals a mutation hotspot around the ParaHox gene cluster”. Proceedings of the National Academy of Sciences of the United States of America 114 (29): 7677–7682. (July 2017). doi:10.1073/pnas.1702930114. PMC 5530673. PMID 28674003.
- ^ “The islet beta cell-enriched MafA activator is a key regulator of insulin gene transcription”. J. Biol. Chem. 280 (12): 11887–94. (March 2005). doi:10.1074/jbc.M409475200. PMID 15665000.
関連文献
編集- “In vivo reprogramming of adult pancreatic exocrine cells to β-cells”. Nature 455 (7213): 627–32. (2008). Bibcode: 2008Natur.455..627Z. doi:10.1038/nature07314. PMC 9011918. PMID 18754011.
- “Pancreas duodenum homeobox-1 regulates pancreas development during embryogenesis and islet cell function in adulthood.”. Eur. J. Endocrinol. 146 (2): 129–41. (2002). doi:10.1530/eje.0.1460129. PMID 11834421.
- “Characterization of somatostatin transactivating factor-1, a novel homeobox factor that stimulates somatostatin expression in pancreatic islet cells.”. Mol. Endocrinol. 7 (10): 1275–83. (1994). doi:10.1210/mend.7.10.7505393. PMID 7505393.
- “Localization of human homeodomain transcription factor insulin promoter factor 1 (IPF1) to chromosome band 13q12.1.”. Genomics 28 (1): 125–6. (1995). doi:10.1006/geno.1995.1120. PMID 7590740.
- “Isolation, characterization, and chromosomal mapping of the human insulin promoter factor 1 (IPF-1) gene.”. Diabetes 45 (6): 789–94. (1996). doi:10.2337/diabetes.45.6.789. PMID 8635654.
- “Transcriptional activation of the GLUT2 gene by the IPF-1/STF-1/IDX-1 homeobox factor.”. Mol. Endocrinol. 10 (11): 1327–34. (1997). doi:10.1210/mend.10.11.8923459. PMID 8923459.
- “Involvement of the homeodomain-containing transcription factor PDX-1 in islet amyloid polypeptide gene transcription.”. Biochem. Biophys. Res. Commun. 229 (3): 746–51. (1997). doi:10.1006/bbrc.1996.1875. PMID 8954967.
- “Purification of the beta-cell glucose-sensitive factor that transactivates the insulin gene differentially in normal and transformed islet cells.”. Proc. Natl. Acad. Sci. U.S.A. 93 (26): 15057–62. (1997). doi:10.1073/pnas.93.26.15057. PMC 26355. PMID 8986763.
- “Pancreatic agenesis attributable to a single nucleotide deletion in the human IPF1 gene coding sequence.”. Nat. Genet. 15 (1): 106–10. (1997). doi:10.1038/ng0197-106. PMID 8988180.
- “Hormonal regulation of an islet-specific enhancer in the pancreatic homeobox gene STF-1.”. Mol. Cell. Biol. 17 (5): 2598–604. (1997). doi:10.1128/mcb.17.5.2598. PMC 232109. PMID 9111329.
- “Identification of cis- and trans-active factors regulating human islet amyloid polypeptide gene expression in pancreatic beta-cells.”. J. Biol. Chem. 272 (18): 11986–93. (1997). doi:10.1074/jbc.272.18.11986. PMID 9115263.
- “The p38/reactivating kinase mitogen-activated protein kinase cascade mediates the activation of the transcription factor insulin upstream factor 1 and insulin gene transcription by high glucose in pancreatic beta-cells.”. J. Biol. Chem. 272 (33): 20936–44. (1997). doi:10.1074/jbc.272.33.20936. PMID 9252422.
- “Missense mutations in the insulin promoter factor-1 gene predispose to type 2 diabetes.”. J. Clin. Invest. 104 (9): R33–9. (1999). doi:10.1172/JCI7449. PMC 481047. PMID 10545530.
- “Defective mutations in the insulin promoter factor-1 (IPF-1) gene in late-onset type 2 diabetes mellitus.”. J. Clin. Invest. 104 (9): R41–8. (1999). doi:10.1172/JCI7469. PMC 409821. PMID 10545531.
- “Transcription factor BETA2 acts cooperatively with E2A and PDX1 to activate the insulin gene promoter.”. J. Biol. Chem. 275 (3): 2199–204. (2000). doi:10.1074/jbc.275.3.2199. PMID 10636926.
- “Pancreatic homeodomain transcription factor IDX1/IPF1 expressed in developing brain regulates somatostatin gene transcription in embryonic neural cells.”. J. Biol. Chem. 275 (25): 19106–14. (2000). doi:10.1074/jbc.M000655200. PMID 10751390.
- “DNA cloning using in vitro site-specific recombination.”. Genome Res. 10 (11): 1788–95. (2001). doi:10.1101/gr.143000. PMC 310948. PMID 11076863.
- “DNA binding and transcriptional activation by a PDX1.PBX1b.MEIS2b trimer and cooperation with a pancreas-specific basic helix-loop-helix complex.”. J. Biol. Chem. 276 (21): 17985–93. (2001). doi:10.1074/jbc.M100678200. PMID 11279116.
- “Conserved sequences in a tissue-specific regulatory region of the pdx-1 gene mediate transcription in Pancreatic beta cells: role for hepatocyte nuclear factor 3 beta and Pax6.”. Mol. Cell. Biol. 22 (13): 4702–13. (2002). doi:10.1128/MCB.22.13.4702-4713.2002. PMC 133887. PMID 12052878.
- “Exendin-4 differentiation of a human pancreatic duct cell line into endocrine cells: involvement of PDX-1 and HNF3beta transcription factors.”. J. Cell. Physiol. 192 (3): 304–14. (2002). doi:10.1002/jcp.10143. PMID 12124776.