ファゴソーム
ファゴソーム(英: phagosome)は、食作用によって食細胞に取り込まれた粒子の周りに形成される小胞である。ファゴソームは微生物、老化細胞、またはアポトーシスを起こした細胞の周囲に細胞膜が融合することで形成される。ファゴソームには膜結合タンパク質が存在し、リソソームをリクルートして融合することで成熟したファゴリソソームを形成する。リソソームは加水分解酵素と活性酸素種(ROS)を含んでおり、病原体を破壊し分解する。ファゴソームは非専門食細胞(ノンプロフェッショナル食細胞)でも形成されるが、より小さな粒子しか取り込めず、ROSも含まれていない。粒子の消化から得られた有用な物質(アミノ酸など)は細胞質基質へ移行し、老廃物はエキソサイトーシスによって除去される。ファゴソームの形成は組織の恒常性、病原体に対する自然免疫と獲得免疫の双方において重要である。
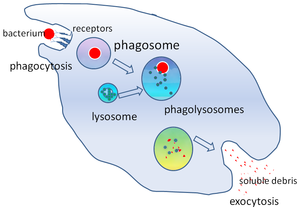
しかしながら、一部の細菌は宿主細胞への侵入戦略として食作用を利用する。こうした生物はファゴリソソームの中で繁殖するか(Coxiella属など)[1]、リソソームと融合する前に細胞質へ逃れる(リケッチアなど)[2]。結核菌Mycobacterium tuberculosis[3][4]、ヨーネ菌Mycobacterium avium paratuberculosis[5]を含むマイコバクテリウム属の多くは宿主のマクロファージを操り、リソソームの融合によるファゴリソソームの形成を防ぐ。こうしたファゴソームの不完全な成熟によって、内部の病原体にとって好ましい環境が維持される[6]。
形成
編集ファゴソームは細菌やアポトーシスを起こした細胞、老化細胞を分解するのに十分な大きさがあり、多くの場合その直径は0.5 μm以上である[7]。このことは、ファゴソームはナノメートルオーダーであるエンドソームよりも桁違いに大きいことを意味する。
ファゴソームは病原体またはオプソニンが膜貫通受容体に結合した際に形成される。膜貫通受容体は食細胞の表面にランダムに分布している。結合に伴って、"outside-in"シグナルがアクチンの重合と仮足の形成を開始し、微生物を取り囲んで融合する。プロテインキナーゼC、PI3キナーゼ(PI3K)、ホスホリパーゼC(PLC)は、すべてシグナル伝達と粒子のインターナリゼーションの制御に必要である[8]。病原体が取り囲まれると、ジッパー様の機構でより多くの細胞表面受容体が粒子に結合できるようになり、結合のアビディティが増大する[9]。Fc受容体(FcR)、補体受容体(CR)、マンノース受容体、Dectin-1は食作用受容体であり、これらは線維芽細胞などの非食作用性細胞で発現された場合には食作用を誘導する[10]。Toll様受容体など他のタンパク質も病原体のパターン認識に関与しており、しばしばファゴソームにリクルートされるが、これらは非食作用性細胞で食作用を開始することはないため、食作用受容体とはみなされていない。
オプソニン化
編集オプソニンは抗体や補体など、病原体に結合して食作用をアップレギュレーションする分子タグである。免疫グロブリンG(IgG)は血清中の抗体の主要なタイプである。IgGは獲得免疫系の一部をなすが、病原体に対する食作用のためにマクロファージをリクルートすることで自然免疫系と関連づける。抗体はFab領域で微生物に結合し、Fc領域でFcRに結合して食作用を誘導する。
補体を介したインターナリゼーションでは膜の突出はずっと小さなものとなるが、どちらの経路も下流のシグナルはRho GTPアーゼの活性化に収束する[11]。Rhoは、ファゴソームがエンドソームやリソソームとの融合するために必要なアクチンの重合を制御する。
非食作用性細胞
編集他の非専門食細胞もある程度の食作用活性を持ち、甲状腺と膀胱の上皮細胞は赤血球を取り込み、網膜の上皮細胞は桿体細胞を取り込むことができる[7]。しかしながら、非専門食細胞はFcRなどの特異的食作用受容体を発現しておらず、インターナリゼーションの速度はずっと低い。
一部の侵襲性細菌も、宿主への取り込みを媒介するために非専門食細胞で食作用を誘導することができる。例えば、赤痢菌Shigellaは宿主の細胞骨格を変化させ、腸細胞の基底側への進入を可能にする[12]。
構造
編集ファゴソームの膜は細胞膜の融合によって形成されるため、両者のリン脂質二重層の基本的組成は同一である。その後、特に取り込まれた粒子が寄生虫などのように非常に大きなものである場合、エンドソームとリソソームがファゴソームに融合し、その膜構成に寄与する[13]。また、これらはさまざまな膜タンパク質もファゴソームに運搬し、構造に変化を加える。
人工的な低密度ラテックスビーズを取り込ませ、スクロース密度勾配遠心によって精製することで、ファゴソームの構造や組成の研究が行われている[14]。さまざまな時点でファゴソームを精製することで、その成熟過程の特徴づけが行われる。初期ファゴソームはRab5の存在によって特徴づけられ、後期ファゴソームへ成熟するにつれてRab7へと移行する。
成熟過程
編集新たに形成されたファゴソームは、それ自体が殺菌作用を持っているのではない。ファゴソームは成熟するにつれて、pH 6.5からpH 4へと酸性化し、特徴的なタンパク質マーカーや加水分解酵素を獲得していく。酵素によって至適pHは異なるため、それぞれ成熟過程の狭い段階で機能するようになっている。酵素の活性がpHの変化によって微調整されることで、ファゴソームによる処理の柔軟性は増大する。ファゴソームは細胞骨格の微小管に沿って移動し、動的なkiss-and-run機構によって逐次的にエンドソームやリソソームと融合する[15]。この細胞内輸送はファゴソームのサイズに依存している。大きなもの(直径約3 μm)は常に細胞の周縁部から核周辺領域へ向かって輸送されるのに対し、より小さなもの(直径約1 μm)は細胞の中心部と周縁部の間で双方向に輸送される[16]。V-ATPaseはファゴソーム内を酸性化するために運搬され、病原体にとって厳しい環境を作り出し、タンパク質の分解を促進する。細菌のタンパク質は低いpHでは変性し、それによってプロテアーゼがアクセスしやすくなる。こうしたプロテアーゼは酸性環境の影響を受けない。酵素は細胞外への排出の前にファゴリソソームからリサイクルされ、廃棄されることはない。ファゴソームが成熟するにつれて、リン脂質膜の組成も変化する[14]。
ファゴソームの融合には、その内容物によって数分から数時間かかる。FcRやマンノース受容体を介した融合は30分以内に終了するのに対し、ラテックスビーズを含むファゴソームがリソソームと融合するのには数時間かかる場合がある[7]。ファゴソーム膜の組成が成熟の速度に影響を与えることが示唆されている。結核菌M. tuberculosisは非常に疎水的な細胞壁を持っており、これが膜のリサイクリングや融合因子のリクルートを防いでいると考えられている。その結果ファゴソームはリソソームと融合せず、微生物は分解を免れる[17]。
小さな内腔側分子は大きな分子よりも融合によって速く移行する。このことは、ファゴソームと他の小胞とのkiss-and-runの過程では小さな水性チャネルが形成され、限定的な物質交換のみが行われていることを示唆している[7]。
融合の調節
編集インターナリゼーションの直後、F-アクチンは新たに形成されたファゴソームから脱重合し、エンドソームが融合してタンパク質を送達できるようになる[7]。成熟過程は、その調節を行うRabGTPアーゼのタンパク質マーカーによって初期段階と後期段階に分けられる。Rab5は初期ファゴソームに存在し、Rab7によって特徴づけられる後期ファゴソームへの移行を制御する[18]。
Rab5はPI3Kや、Vps34など他のテザリングタンパク質をファゴソーム膜へリクルートし、エンドソームがタンパク質をファゴソームへ運搬できるようにする。Rab5は、酵母ではCORVET複合体とHOPS複合体を介してRab7への移行に部分的に関与している[18]。哺乳類での正確な成熟過程はあまり理解されていないが、HOPSはグアニンヌクレオチド解離阻害因子(GDI)に置き換わってRab7に結合することが示唆されている[19]。Rab11は膜の再生に関与している[20]。
ファゴリソソーム
編集ファゴソームはリソソームと融合してファゴリソソームを形成する。ファゴリソソームはさまざま殺菌作用を有する。ファゴリソソームには活性酸素種や活性窒素種、加水分解酵素が含まれる。また、この区画は膜を越えてH+を輸送するプロトンポンプ(V-ATPase)の作用のために酸性であり、このことも細菌タンパク質の変性に利用される。
ファゴリソソームの正確な性質は食細胞のタイプによって異なる。樹状細胞のファゴリソソームは、マクロファージや好中球のものよりも殺菌作用は弱い。また、マクロファージは炎症促進性の"killer"型のM1と"repair"型のM2に分けられる。M1マクロファージのファゴリソソームはアルギニンを反応性の高い一酸化窒素へ代謝することができるが、一方でM2はアルギニンをオルニチンの産生に利用し、細胞増殖と組織修復を促進する[21]。
機能
編集病原体の分解
編集マクロファージと好中球は病原体の分解の大部分を担う専門食細胞(プロフェッショナル食細胞)であるが、両者は異なる殺菌方法を持つ。好中球にはファゴソームと融合する顆粒が存在する。顆粒にはNADPHオキシダーゼとミエロペルオキシダーゼが含まれ、呼吸バーストによって病原体を死滅させるため、有毒な酸素・塩素誘導体を産生する。プロテアーゼと抗菌ペプチドもファゴリソソームへ放出される。マクロファージにはこうした顆粒は存在せず、ファゴリソソームの酸性化、グリコシダーゼ、プロテアーゼによる微生物の分解により強く依存している[20]。樹状細胞のファゴソームはリソソームプロテアーゼの濃度は低く、プロテアーゼインヒビターも存在し、酸性度はより低く、加水分解活性もずっと弱い。
炎症
編集ファゴソームの形成は一般的なシグナル伝達分子を介して炎症と結び付けられている。PI3KとPLCはインターナリゼーション機構と炎症応答の開始の双方に関与している[8]。これら2つのタンパク質とRho GTPアーゼは自然免疫応答の重要な構成要素であり、サイトカインの産生を誘導し、MAPキナーゼシグナル伝達カスケードを活性化する。IL-1β、IL-6、TNF-α、IL-12など炎症性サイトカインは全て産生される[7]。
この過程は緊密な調節を受けており、炎症応答はファゴソーム内の粒子のタイプによって変化する。病原体が感染してアポトーシスを起こした細胞は炎症応答を開始するが、組織の正常なターンオーバーの過程で分解される損傷細胞は応答を開始することはない。応答はオプソニンを介した食作用によっても異なる。FcRとマンノース受容体を介した反応は炎症性の活性酸素種とアラキドン酸分子を産生するが、CRを介した反応ではこれらの産生はみられない[7]。
抗原提示
編集未成熟な樹状細胞は食作用を行うが、成熟した樹状細胞では細胞骨格のリモデリングに関与するRho GTPアーゼの変化のため食作用は行われない[20]。樹状細胞のファゴソームは病原体の分解ではなく主に抗原提示に関与するものであるため、マクロファージや好中球のものよりも加水分解活性や酸性度が低い。タンパク質断片を細菌の特異的認識に適したサイズに保持しておく必要があるため、ペプチドは部分的にしか分解されない[20]。細菌由来のペプチドはMHCへ輸送される。リンパ球に提示されたペプチド抗原は、T細胞受容体に結合してT細胞を活性化することで自然免疫と獲得免疫の橋渡しをする[8]。この機構は哺乳類、鳥類など顎口上綱に特異的なものであり、昆虫は獲得免疫を持たない[22]。
栄養素
編集アメーバなどの単細胞生物は、免疫戦略ではなく栄養素を獲得する手段として食作用を利用する。これらの生物は他のより小さな微生物を取り込み、ファゴソーム内で消化する。1分で1つの微生物を消化することができ、その速度は専門食細胞よりもかなり速い[23]。土壌に生息するアメーバであるキイロタマホコリカビDictyostelium discoideumの場合、その主要な食料源はヒトにレジオネラ症を引き起こすレジオネラ・ニューモフィラLegionella pneumophilaである[24]。アメーバのファゴソームの成熟過程はマクロファージのものと非常に類似しているため、成熟過程を研究するためのモデル生物として利用されている[15]。
組織のクリアランス
編集ファゴソームは組織の恒常性を維持するため、老化細胞やアポトーシスを起こした細胞を分解する。赤血球は体内で最もターンオーバー率が高いものの1つであり、肝臓と脾臓のマクロファージによる食作用を受ける。胚での死細胞の除去過程はよく特徴づけられてはいないが、マクロファージや他の造血幹細胞に由来する細胞によって除去されているわけではない[25]。アポトーシスを起こした細胞に対して専門食細胞が食作用を行うのは成体のみである。炎症過程は特定の病原体関連分子パターン(PAMP)やダメージ関連分子パターン(DAMP)によってのみ開始されるため、老化細胞の除去は炎症反応を促進しない[13]。
オートファゴソーム
編集オートファゴソームは、主に細胞質の損傷したオルガネラ(ミトコンドリアなど)を選択的に分解するために利用される点でファゴソームとは異なる。しかしながら、飢餓状態やストレスを受けた状態では、オートファゴソームはオルガネラを非選択的に分解して細胞にアミノ酸や他の栄養素を供給する[26]。オートファジーは専門食細胞に限定されているのではなく、細胞生物学者クリスチャン・ド・デューブによって最初に発見されたのはラットの肝細胞においてである[27]。オートファゴソームは二重膜構造を持ち、内側の膜は取り込まれたオルガネラに由来し、外側の膜は小胞体または小胞体-ゴルジ体中間区画(ERGIC)で形成されたものであると考えられている[28]。オートファゴソームもリソソームと融合して内容物を分解する。結核菌M. tuberculosisがファゴソームの酸性化を阻害した場合には、インターフェロンγがオートファジーを誘導し、成熟過程をレスキューする[29]。
細菌による回避と操作
編集多くの細菌がファゴソームの殺菌作用を回避する機構または食作用を進入戦略として利用する機構を進化させている。
- 結核菌M. tuberculosisは、活性酸素種を産生しない下気道のM2マクロファージを標的とする[30]。また、結核菌はPtpAやSapMなどのホスファターゼを分泌することでシグナル伝達経路を操作し、タンパク質のリクルートやファゴソームの酸性化を防ぐ[7][31]。
- レジオネラ・ニューモフィラL. pneumophilaはファゴソーム膜をリモデリングし、分泌経路の他の部分の小胞を模倣する。そのためリソソームはファゴソームを認識せず、融合しない。レジオネラは宿主の輸送に干渉する毒素を分泌するため、レジオネラを含む空胞には、通常は小胞体やERGICに存在する膜タンパク質がリクルートされる[32]。その結果、改変されたファゴソームへ分泌小胞が送られ、微生物へ栄養素が運搬される。
- リステリア・モノサイトゲネスListeria monocytogenesはポアを形成するタンパク質リステリオリシンOを分泌するため、微生物はファゴソームから細胞質へ逃れることができる。リステリオリシンはファゴソームの酸性環境によって活性化される[33]。さらに、リステリアはファゴソームを逃れるために2種類のホスホリパーゼCを分泌する。
出典
編集- ^ “Biochemical stratagem for obligate parasitism of eukaryotic cells by Coxiella burnetii”. Proceedings of the National Academy of Sciences of the United States of America 78 (5): 3240–4. (May 1981). doi:10.1073/pnas.78.5.3240. PMC 319537. PMID 6942430.
- ^ “Rickettsia Species (As Organisms)”. Annual Review of Microbiology 44: 131–153. (1990). doi:10.1146/annurev.micro.44.1.131.
- ^ “Immune control of tuberculosis by IFN-gamma-inducible LRG-47”. Science 302 (5645): 654–9. (October 2003). Bibcode: 2003Sci...302..654M. doi:10.1126/science.1088063. PMID 14576437.
- ^ “A membrane protein preserves intrabacterial pH in intraphagosomal Mycobacterium tuberculosis”. Nature Medicine 14 (8): 849–54. (August 2008). doi:10.1038/nm.1795. PMC 2538620. PMID 18641659.
- ^ “Characterization of the intracellular survival of Mycobacterium avium ssp. paratuberculosis: phagosomal pH and fusogenicity in J774 macrophages compared with other mycobacteria”. Cellular Microbiology 3 (8): 551–66. (August 2001). doi:10.1046/j.1462-5822.2001.00139.x. PMID 11488816.
- ^ “How does Mycobacterium avium subsp. paratuberculosis resist intracellular degradation?”. The Veterinary Quarterly 23 (4): 153–62. (November 2001). doi:10.1080/01652176.2001.9695105. PMID 11765232.
- ^ a b c d e f g h “Mechanisms of phagocytosis in macrophages”. Annual Review of Immunology 17 (1): 593–623. (April 1999). doi:10.1146/annurev.immunol.17.1.593. PMID 10358769.
- ^ a b c “Phagocytosis and the inflammatory response”. The Journal of Infectious Diseases 187 Suppl 2 (s2): S340-5. (June 2003). doi:10.1086/374747. PMID 12792849.
- ^ “Integrin-dependent phagocytosis: spreading from microadhesion to new concepts”. Journal of Cell Science 121 (11): 1773–83. (June 2008). doi:10.1242/jcs.018036. PMID 18492791.
- ^ “Phagocytosis of microbes: complexity in action”. Annual Review of Immunology 20 (1): 825–52. (April 2002). doi:10.1146/annurev.immunol.20.103001.114744. PMID 11861619.
- ^ “Differences in the mode of phagocytosis with Fc and C3 receptors in macrophages”. Scandinavian Journal of Immunology 6 (8): 797–807. (August 1977). doi:10.1111/j.1365-3083.1977.tb02153.x. PMID 561436.
- ^ “Shigella flexneri Interactions with the Basolateral Membrane Domain of Polarized Model Intestinal Epithelium: Role of Lipopolysaccharide in Cell Invasion and in Activation of the Mitogen-Activated Protein Kinase ERK”. Infection and Immunity 70 (3): 1150–8. (March 2002). doi:10.1128/IAI.70.3.1150-1158.2002. PMC 127798. PMID 11854195.
- ^ a b “Phagocytosis: the convoluted way from nutrition to adaptive immunity”. Immunological Reviews 207 (1): 158–65. (October 2005). doi:10.1111/j.0105-2896.2005.00319.x. PMID 16181334.
- ^ a b “Molecular characterization of phagosomes”. The Journal of Biological Chemistry 269 (51): 32194–200. (December 1994). PMID 7798218.
- ^ a b “High-resolution dissection of phagosome maturation reveals distinct membrane trafficking phases”. Molecular Biology of the Cell 13 (10): 3508–20. (October 2002). doi:10.1091/mbc.E02-04-0206. PMC 129962. PMID 12388753.
- ^ “Phagosomal transport depends strongly on phagosome size”. Scientific Reports 7 (1): 17068. (December 2017). Bibcode: 2017NatSR...717068K. doi:10.1038/s41598-017-17183-7. PMC 5719076. PMID 29213131.
- ^ “Phagosome maturation and fusion with lysosomes in relation to surface property and size of the phagocytic particle”. European Journal of Cell Biology 74 (1): 49–62. (September 1997). PMID 9309390.
- ^ a b “How nascent phagosomes mature to become phagolysosomes”. Trends in Immunology 33 (8): 397–405. (August 2012). doi:10.1016/j.it.2012.03.003. PMID 22560866.
- ^ “Identification of two evolutionarily conserved genes regulating processing of engulfed apoptotic cells”. Nature 464 (7289): 778–82. (April 2010). Bibcode: 2010Natur.464..778K. doi:10.1038/nature08853. PMC 2901565. PMID 20305638.
- ^ a b c d “Phagocytosis and antigen presentation in dendritic cells”. Immunological Reviews 219 (1): 143–56. (October 2007). doi:10.1111/j.1600-065X.2007.00552.x. PMID 17850487.
- ^ “Anatomy of a discovery: m1 and m2 macrophages”. Frontiers in Immunology 6: 212. (5 May 2015). doi:10.3389/fimmu.2015.00212. PMC 4419847. PMID 25999950.
- ^ “The adaptive immune system of fish”. Developments in Biological Standardization 90: 15–21. (1997). PMID 9270830.
- ^ “Eat, kill or die: when amoeba meets bacteria”. Current Opinion in Microbiology 11 (3): 271–6. (June 2008). doi:10.1016/j.mib.2008.05.005. PMID 18550419.
- ^ “Intracellular growth of Legionella pneumophila in Dictyostelium discoideum, a system for genetic analysis of host-pathogen interactions”. Infection and Immunity 68 (5): 2939–47. (May 2000). doi:10.1128/iai.68.5.2939-2947.2000. PMC 97507. PMID 10768992.
- ^ “Origins and functions of phagocytes in the embryo”. Experimental Hematology 28 (6): 601–11. (June 2000). doi:10.1016/s0301-472x(00)00157-0. PMID 10880746.
- ^ “Mitophagy: mechanisms, pathophysiological roles, and analysis”. Biological Chemistry 393 (7): 547–64. (July 2012). doi:10.1515/hsz-2012-0119. PMC 3630798. PMID 22944659.
- ^ Castro-Obregon, Susana (2010). “The Discovery of Lysosomes and Autophagy”. Nature Education 3 (9): 49.
- ^ “The ER-Golgi intermediate compartment feeds the phagophore membrane”. Autophagy 10 (1): 170–2. (January 2014). doi:10.4161/auto.26787. PMC 4389871. PMID 24220263.
- ^ “Autophagy is a defense mechanism inhibiting BCG and Mycobacterium tuberculosis survival in infected macrophages”. Cell 119 (6): 753–66. (December 2004). doi:10.1016/j.cell.2004.11.038. PMID 15607973.
- ^ “Mycobacteria manipulate macrophage recruitment through coordinated use of membrane lipids”. Nature 505 (7482): 218–22. (January 2014). doi:10.1038/nature12799. PMC 3961847. PMID 24336213.
- ^ “Mycobacterium tuberculosis-secreted phosphatases: from pathogenesis to targets for TB drug development”. Trends in Microbiology 21 (2): 100–9. (February 2013). doi:10.1016/j.tim.2012.09.002. PMID 23084287.
- ^ Roy, Craig R.; Kagan, Jonathan C. (1 January 2013) (英語). Evasion of Phagosome Lysosome Fusion and Establishment of a Replicative Organelle by the Intracellular Pathogen Legionella pneumophila. Landes Bioscience
- ^ “The cell biology of Listeria monocytogenes infection: the intersection of bacterial pathogenesis and cell-mediated immunity”. The Journal of Cell Biology 158 (3): 409–14. (August 2002). doi:10.1083/jcb.200205009. PMC 2173830. PMID 12163465.