クエン酸シンターゼ
クエン酸シンターゼ(クエンさんシンターゼ、Citrate synthase)は、ほぼ全ての生細胞に含まれ、クエン酸回路の第一段階の速度を調整する酵素である[1]。クエン酸シンターゼは、真核生物細胞のミトコンドリアマトリックスに局在するが、ミトコンドリアではなく細胞核のDNAによってコードされる。細胞質のリボソームで合成され、その後ミトコンドリアのマトリックスに輸送される。なお、クエン酸シンターゼは、完全なミトコンドリアの存在量を示すマーカーとしても用いられている。
| Citrate synthase | |
|---|---|
| 識別子 | |
| 略号 | CS |
| Entrez | 1431 |
| HUGO | 2422 |
| OMIM | 118950 |
| UniProt | O75390 |
| 他のデータ | |
| EC番号 (KEGG) | 2.3.3.1 |
| 遺伝子座 | Chr. 12 p11-qter |
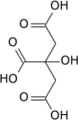
クエン酸シンターゼは、アセチルCoAの酢酸残基をオキサロ酢酸に付加し、クエン酸を合成する反応を触媒する[1]。オキサロ酢酸は、クエン酸回路を一周すると再生される。
アセチルCoA + オキサロ酢酸 + 水 → クエン酸 + 補酵素A
オキサロ酢酸が最初に酵素に結合すると、酵素の形が変化し、アセチルCoAの結合部位が形成される。シトロイルCoAが生成するとさらに構造が変化し、チオエステルを加水分解し、補酵素Aを遊離する。これにより、チオエステル結合の切断により放出されるエネルギーが縮合反応を駆動する。
構造
編集クエン酸シンターゼの437個の残基は、それぞれ20個のαヘリックスを持つ2つのサブユニットを構成する。
αヘリックスは、クエン酸シンターゼの構造の約75%を占め、その他は13残基のβシートとランダムな構造である。この2つのサブユニットの間の溝に活性部位が存在する。その中に2つの結合部位があり、そのうち1つはクエン酸またはオキサロ酢酸、もう1つは補酵素Aを保持するものである。活性部位には、3つの重要な残基His274、His320、Asp375が存在し、基質への作用の選択性は高い。
左図は、クエン酸シンターゼの三次構造である。酵素は、どちらかの基質が結合することで上図(開状態)から下図(閉状態)に構造が変化する[2]。
機構
編集クエン酸シンターゼは、アセチルCoA(H3CCO-SCoA)とオキサロ酢酸(COO-CH2COCOO-) からクエン酸(COO-CH2COHCOOCH2COO-)と補酵素A (H-SCoA) への変換を触媒する活性中心に、3つの重要なアミノ酸残基を持つ。この化学変化は、Asp375の側鎖の負電荷を持った酸素原子がアセチルCoAのα炭素を脱プロトン化することで開始する。これにより電子が押し出され、カルボニル基の炭素原子と二重結合を形成し、His274の側鎖のどちらかの窒素原子からC=Oの酸素原子にプロトンを与える。これにより、窒素原子上に不対電子が形成されて側鎖が中和され、エノール中間体 (CH2COH-SCoA) が生成する。この時点で、His274のアミノ基の不対電子が酸素原子に結合したプロトンを攻撃する。酸素原子は、カルボニル結合を回復し、C=C二重結合を単結合にして、オキサロ酢酸のカルボニル炭素 (COO-CH2COCOO-) を求核攻撃させる。これにより、カルボニル結合の二重結合が単結合になり、His320のアミノ基の1つを脱プロトン化し、側鎖の窒素原子の1つが中和される。この求核付加反応により、シトロイルCoA (COOCH2CHCOOCH2COHSCoA2-) が生成する。この時点で、水分子が導入され、His320のアミノ基によって脱プロトン化されて加水分解が始まる。酸素原子の1つの不対電子がシトロイルCoAのカルボニル炭素を求核攻撃し、四面体型の中間体を形成し、-SCoA基が外れてカルボニルが再形成される。-SCoA基はプロトン化されて補酵素A (HSCoA) となる。最終的に、前の段階でカルボニル基に付加したヒドロキシル基が脱プロトン化し、クエン酸 (-COOCH2COHCOO-CH2COO-) が形成される[3]。
阻害
編集高濃度のATP、アセチルCoA、NADHが存在すると、エネルギー供給が細胞にとって高すぎるため、この酵素は、ATP:ADP、アセチルCoA:CoA、NADH:NADが高い比率になると阻害される。また、スクシニルCoAやクエン酸によって生成物阻害が起こる。アセチルCoAのアナログによるクエン酸シンターゼの阻害は、良く研究されており、単一の活性中心が存在すると証明するために重要な役割を果たした。これらの実験により、この活性中心が2つの形をとり、それぞれがリガーゼとヒドロラーゼの活性に関与することを明らかとした[2]。このタンパク質は、アロステリック制御のモデルとしても用いられる[4]。
経路図
編集以下の遺伝子、タンパク質、代謝それぞれの記事をクリックできる [5]
出典
編集- ^ a b Weigand, Georg, and Steven J. Remington (1986). “Citrate Synthase: Structure, Control, and Mechanism”. Ann. Rev. Biophys. Biophys. Chem.: 98. doi:10.1146/annurev.bb.15.060186.000525.
- ^ a b Ernat BAYER, Barbara BAUER, Hermann EGGERER (1981). “Evidence from Inhibitor Studies for Conformational Changes of Citrate Synthase”. Eur J Biochem 120: 155-160. doi:10.1111/j.1432-1033.1981.tb05683.x.
- ^ Lehninger (2005). Principles of Biochemistry: Fourth Edition. W.H. Freeman and Co. Pages 608-609.
- ^ T. Selwood and E. K. Jaffe. (2011). “Dynamic dissociating homo-oligomers and the control of protein function.”. Arch. Biochem. Biophys. 519 (2): 131-43. doi:10.1016/j.abb.2011.11.020. PMC 3298769. PMID 22182754.
- ^ この双方向伝達経路地図はWikiPathwaysで編集できる: TCA_Cycle_WP78
外部リンク
編集- Citrate synthase - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス